题目内容
【题目】如图所示三套实验装置,分别回答下列问题. 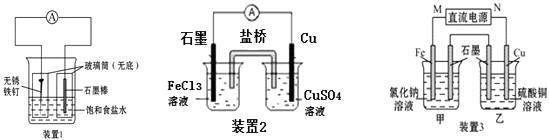
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
【答案】
(1)O2+2H2O+4e﹣═4OH﹣
(2)负极;Fe3++e﹣=Fe2+
(3)阳极;2H2O+2e﹣=H2↑+2OH﹣或2H++2e﹣═H2↑;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;224
2Cu+O2↑+4H+;224
【解析】解:(1)铁发生吸氧腐蚀,正极发生还原反应,氧气得到电子被还原生成OH﹣ , 电极方程式为O2+2H2O+4e﹣═4OH﹣ , 所以答案是:O2+2H2O+4e﹣═4OH﹣;(2)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+ , 形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e﹣=Fe2+ , 所以答案是:负; Fe3++e﹣=Fe2+;(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成OH﹣ , 应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e﹣═H2↑,所以答案是:阳; 2H2O+2e﹣=H2↑+2OH﹣或2H++2e﹣═H2↑;②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O ![]() 2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 ![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O | + | 2e﹣ | ═ | 2OH﹣ | + | H2↑ |
2mol | 22.4L | |||||
0.02mol | V |
V= ![]() =0.224L,即224mL,
=0.224L,即224mL,
所以答案是:224.