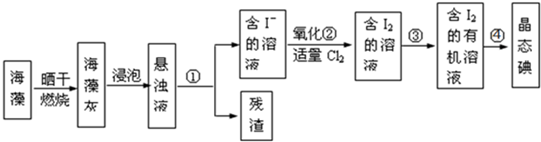
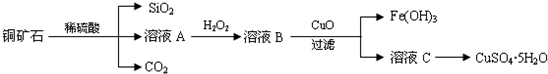
题目内容
2.实脸室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4流程如图1:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入B(填“A”或“B”).
(2)如图2所示,过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁.
(3)判断流程中沉淀是否洗净所用的试剂是AgNO3溶液(或硝酸酸化的AgNO3溶液).高温焙烧时,用于盛放固体的仪器名称是坩埚.
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用如图3所示装置制备.装置B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl.F中试剂的作用是吸收水蒸气.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为碱石灰(或NaOH与CaO混合物).
(5)固体AlCl3属于分子晶体,AlCl3属于强电解质.(强或弱)
分析 MgCl2、AlCl3的混合溶液与过量氨水反应会得到氢氧化镁以及氢氧化铝的混合物沉淀,将沉淀洗涤干燥进行焙烧可以得到MgAl2O4.
(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,先加入氨水,再加入盐的混合溶液,会使两种沉淀同时生成;
(2)为了防止液体溅出,在过滤时应该将漏斗的尖嘴部分紧贴烧杯的内壁;
(3)根据题意可知,沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入硝酸酸化的硝酸银溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净;
(4)根据所给的装置图可知,A装置制取氯气:二氧化锰和浓盐酸反应生成二氯化锰和氯气以及水,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2 ↑+2H2O,氯化氢易挥发,制取的氯气中含有氯化氢,B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,C装置进行氯气干燥,干燥后的氯气进入D装置与铝反应,2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3,E收集产品,F防止空气中的水蒸气进入E装置,氯气有毒,通过G吸收.
B中的饱和食盐水是为了除去混有的HCl气体;氯化铝易发生水解,故F中试剂的作用是防止空气中的水蒸气进入E装置,F用球形干燥管代替,其中可以用碱石灰可起到F和G的作用;
(5)分子晶体的熔沸点较低,一般易溶于有机溶剂;氯化铝在水中完全电离,属于强电解质.
解答 解:MgCl2、AlCl3的混合溶液与过量氨水反应会得到氢氧化镁以及氢氧化铝的混合物沉淀,将沉淀洗涤干燥进行焙烧可以得到MgAl2O4.
(1)25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化铝沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀,
故答案为:B;
(2)过滤实验中的一贴二低三靠为:一贴:滤纸紧贴漏斗内壁,不要留有气泡;二低:a.漏斗内滤纸边缘低于漏斗口边缘,b.漏斗内液面低于滤纸边缘;
三靠:a.倾倒液体时,烧杯与玻璃棒接触,b.玻璃棒末端与漏斗内三层滤纸处接触,c.漏斗下端与承接滤液的烧杯内壁接触.图2所示,过滤时应该将漏斗的尖嘴部分紧贴烧杯的内壁,防止液体溅出,
故答案为:漏斗下端尖嘴未紧贴烧杯内壁;
(3)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行,
故答案为:AgNO3溶液(或硝酸酸性的AgNO3溶液);坩埚;
(4)A装置制取氯气,氯化氢易挥发,制取的氯气中含有氯化氢,氯气在饱和食盐水中溶解度小,B中的饱和食盐水是为了除去混有的HCl气体,因为氯化铝易发生水解,故F中可放试剂浓硫酸,防止空气中的水蒸气进入E装置,F用球形干燥管代替, ,F中可以用碱石灰(或NaOH与CaO混合物),既能吸收尾气氯气,又能防止空气中水蒸气进入E装置,
,F中可以用碱石灰(或NaOH与CaO混合物),既能吸收尾气氯气,又能防止空气中水蒸气进入E装置,
故答案为:除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物);
(5)分子晶体的熔沸点较低,一般易溶于有机溶剂,已知无水AlCl3(183℃升华),说明AlCl3具有分子晶体的物理性质,则属于分子晶体,无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,是氯化铝的水解,说明氯化铝易溶于水,且在水中完全电离,属于强电解质,
故答案为:分子;强.
点评 本题考查物质的制备实验设计,涉及实验操作目的、原理、步骤等有关问题,主要考查了实验方案设计中的实验操作,综合考查了学生的实验探究能力,注意(4)F用球形干燥管代替F中可以用碱石灰(或NaOH与CaO混合物),既能吸收尾气氯气,又能防止空气中水蒸气进入E装置,为易错点,题目难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 酒精可用作燃料,说明酒精燃烧是释放能量的反应 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |
 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
已知:①乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解.
②主要试剂和产品的其它物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式
 .
.(2)制备阿司匹林主反应时,仪器必须干燥的原因是防止醋酸酐与水反应.
(3)合成阿司匹林主反应时,最合适的加热方法是水浴加热,除酒精灯外,该加热装置还需要的玻璃仪器有烧杯(或水浴锅)、温度计.
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离.
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是取少量粗产品于试管中,加适量乙醇(或蒸馏水)溶解,滴加几滴FeCl3溶液,若呈紫色则含水杨酸,若无紫色出现,说明产品中不含水杨酸..
①I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol.
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 当反应②吸收52.96kJ热量时转移2mole- | |
| C. | 反应②的反应物总能量比反应①的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘多了17.00kJ能量 |