题目内容
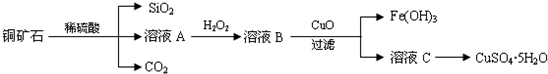
19.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量铝)生产碱式硫酸铁的工艺流程如下:
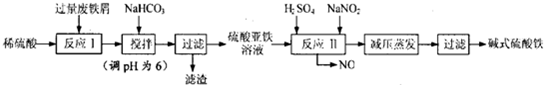
请回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成吸附能力很强的胶体.
(2)已知,常温下部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表.假设沉淀完全时溶液中金属离子的浓度为1×10-5 mol•L-1,估算Ksp[Fe(OH)2]=1×10-15.生产碱式硫酸铁的过程中,加入少量NaHCO3
调溶液pH=6的目的是调节溶液的pH促进Al3+水解转化为沉淀完全除去.
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO${\;}_{3}^{-}$.某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有 SO${\;}_{4}^{2-}$,可供选择的试剂如下:
A.新制氯水 B.0.l mol/L KSCN溶液 C.10%NaOH溶液
D.20%HNO3溶液 E.0.05mol/L酸性KMnO4溶液 F.0.l mol/L BaCl2溶液
请你帮助该同学完成实验,将相关项目填入下表:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
分析 (1)依据氢氧化铁胶体具有吸附悬浮杂质的作用分析净水原理;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,结合离子积常数和溶度积常数计算得到;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
(3)流程分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出;依据氧化还原反应电子守恒计算;
(4)证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,根据提供的试剂需要选择氯化钡溶液和稀硝酸.
解答 解:(1)碱式硫酸铁能够净水的原因是,碱式硫酸铁在溶液中铁离子水解生成了具有较强吸附能量的氢氧化铁胶体,吸附悬浮在水中杂质的起到净水作用;
故答案为:能水解生成具有吸附能力较强的胶体;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,c(H+)=10-9mol/L,c(OH-)=10-5mol/L,依据溶度积常数计算方法得到Ksp=c(Fe2+)c2(OH-)=1.0×10-5mol/L×(10-5mol/L)2=1×10-15(mol/L)3;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
故答案为:1×10-15(mol/L)3;调节溶液PH促进Al3+水解转化为沉淀除去;
(3)分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出的离子方程式为:Fe2++2H++NO2-=Fe3++NO↑+H2O;在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,物质的量=$\frac{1.38t}{69g/mol}$=2×104mol,转移电子2×104mol,依据电子守恒计算:
4NaNO2~4NO~4e-~O2~4e-
4 1
2×104mol n(O2)
n(O2)=5×103mol
V(O2)=5×103mol×22.4mol/L=1.12×105L=112m3;
则应通入标准 状况下的02 的体积为112m3;
故答案为:Fe2++2H++NO2-=Fe3++NO↑+H2O;112;
(4)根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO42-,实验证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,具体步骤为:取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀,得黄棕色溶液,取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案为:
| 操 作 | 现 象 |
| 0.05 mol/L酸性高锰酸钾溶液 | 溶液不褪色 |
| 产生白色沉淀 |
点评 本题考查了实验制备物质的分析应用,离子检验方法和设计,化学方程式,氧化还原反应电子守恒的计算式解题关键,题目难度中等.

 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
已知:①乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解.
②主要试剂和产品的其它物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式
 .
.(2)制备阿司匹林主反应时,仪器必须干燥的原因是防止醋酸酐与水反应.
(3)合成阿司匹林主反应时,最合适的加热方法是水浴加热,除酒精灯外,该加热装置还需要的玻璃仪器有烧杯(或水浴锅)、温度计.
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离.
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是取少量粗产品于试管中,加适量乙醇(或蒸馏水)溶解,滴加几滴FeCl3溶液,若呈紫色则含水杨酸,若无紫色出现,说明产品中不含水杨酸..
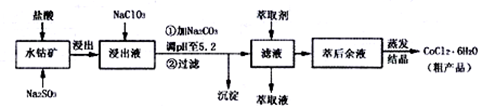
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
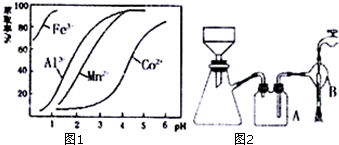
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.
| A. | HCN | B. | CH3COOH | C. | HF | D. | HNO2 |
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 电离平衡右移,电解质分子的浓度不一定减小 |
 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.