题目内容
9.将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:v甲(H2)=3mol•L-1•min-1,v乙(N2)=2mol•L-1•min-1,v丙(NH3)=1mol•L-1•min-1.这段时间内三个容器中合成氨的反应速率的大小关系为( )| A. | v甲>v乙>v丙 | B. | v乙>v甲>v丙 | C. | v甲>v丙>v乙 | D. | v甲=v乙=v丙 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的表示的速率与其化学计量数的比值越大,表示的反应速率越快.
解答 解:反应方程式为:N2+3H2=2NH3,不同物质表示的速率之比等于其化学计量数之比,故不同物质的表示的速率与其化学计量数的比值越大,表示的反应速率越快,则:
$\frac{{v}_{甲}({H}_{2})}{3}$=1mol•L-1•min-1;
$\frac{{v}_{乙}({N}_{2})}{1}$=2mol•L-1•min-1;
$\frac{{v}_{丙}(N{H}_{3})}{2}$=0.5mol•L-1•min-1,
故反应速率v乙>v甲>v丙,
故选:B.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,也可以转化同一物质表示的速率进行比较.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.常温下、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
4.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应不必加热就一定能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
14.如图Ⅰ是NO2(g)+CO(g)═CO2(g)+NO(g) 反应过程中能量示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ.下列有关说法正确的是( )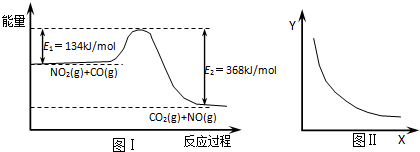

| A. | 该反应的焓变△H=234kJ/mol | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
1.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | ①②③④中任意一种 |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 最外层电子数为8的粒子是稀有气体元素的原子 |
19.为了测定“铁块”中铁元素的含量,实验流程如图所示:

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
(1)试剂A应选择C,试剂B应选择D(填序号)
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
 (1)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C$\stackrel{引燃}{→}$K2S+3CO2↑+N2↑,该反应中氧化剂为S、KNO3,1molS能氧化C0.5mol
(1)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C$\stackrel{引燃}{→}$K2S+3CO2↑+N2↑,该反应中氧化剂为S、KNO3,1molS能氧化C0.5mol