题目内容
【题目】质子膜N2H4燃料电池是一种高效无污染的新型电池(原理示意如图),其反应原理:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-544kJmol-1。下列说法正确的是

A.电极b上发生氧化反应
B.电极a为原电池正极
C.每32gO2参与反应,电池内部释放544kJ热能
D.电路中每通过1mol电子,有1molH+经质子膜进入正极区
【答案】D
【解析】
A.由图可知电极b上通入O2,最终生成水,发生还原反应,为原电池的正极,A错误;
B.由图可知电极a上N2H4生成N2,发生氧化反应,为原电池负极,B错误;
C.由热化学方程式可知,每32O2参与反应,反应放出544kJ 的能量,这些能量大部分转化为电能,只有很少一部分转化为热能,C错误;
D.原电池工作时,阳离子向正极移动,该电池两极之间为质子固体电解质膜,质子即H+可以通过,电路中每通过1mol电子,有1molH+经质子膜进入正极区,D正确。
答案选D。

【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
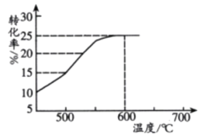
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。