题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
【答案】Ca 离子键、共价键 ![]() r(Al3+)<r(Mg2+) <r(O2-)<r(N3-) HClO4 Al(OH)3 Al(OH) 3+OH-=AlO2-+2H2O
r(Al3+)<r(Mg2+) <r(O2-)<r(N3-) HClO4 Al(OH)3 Al(OH) 3+OH-=AlO2-+2H2O 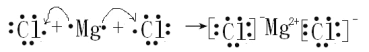
【解析】
根据元素周期表可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为O、⑨为Cl、⑩为Ar。
(1)③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N,同周期,从左到右,原子半径减小,同主族,从上到下,原子半径增大,所以原子半径大小关系为:r(Ca)>r(Mg)>r(Al)r(C)>r(N),最大的是Ca,故答案为:Ca。
(2)⑦为N,其最高价氧化物对应的水化物式HNO3,其氢化物是NH3,二者反应生成NH4NO3,NH4NO3为离子化合物,NH4+与NO3-之间是离子键,NH4+与NO3-之内是共价键,所以含有的化学键类型有离子键、共价键,故答案为:离子键、共价键。
(3)①为Na、⑧为O,其单质在加热条件下反应生成Na2O2,Na2O2是离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)③为Mg、⑤为Al、⑦为N、⑧为O,形成Mg2+、Al3+、N3-、O2-,核外电子层结构相同的离子,核电荷数越大,离子半径越小,其半径由小到大的顺序是r(Al3+)<r(Mg2+) <r(O2-)<r(N3-),故答案为:r(Al3+)<r(Mg2+) <r(O2-)<r(N3-)。
(5)①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为O、⑨为Cl,同周期,从左到右,最高价氧化物对应的水化物中酸性增强,同主族,从上到下,最高价氧化物对应的水化物中酸性减弱,所以酸性最强的是HClO4;呈两性的氢氧化物是Al(OH)3;Al(OH)3与NaOH溶液反应生成偏铝酸钠和水,其离子方程式为:Al(OH) 3+OH-=AlO2-+2H2O,故答案为:HClO4;Al(OH)3;Al(OH) 3+OH-=AlO2-+2H2O。
(6)③为Mg、⑨为Cl,Mg最外层有2个电子,易失去2个电子,Cl最外层有7个电子,易得到1个电子,二者形成MgCl2,用电子式表示其形成化合物的过程为:![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案