题目内容
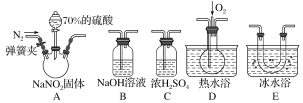
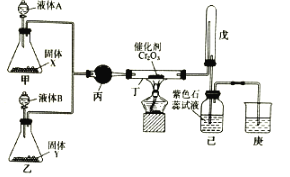
【题目】Ⅰ.二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
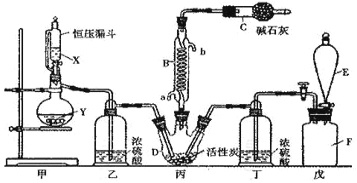
(1)仪器E的名称是_____________,由B的使用可知SO2与氯气之间的反应属于______(填“放”或“吸”)热反应,B处反应管冷却水应从____________ (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是_______________________________________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为___________ %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是_______________________________。
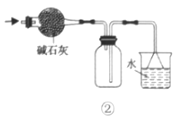
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
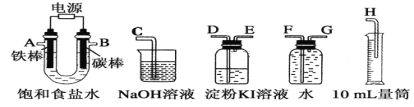
(1)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(2)若装入的饱和食盐水为100mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为112mL(标准状况下)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
【答案】分液漏斗 放 a 该反应为放热反应,降温有利于平衡正向移动,有利于SO2Cl2的生成 c 饱和食盐水 SO2+Cl2+2H2O=H2SO4+2HCl 86.9% SO2Cl2 久置后分解产生 Cl2,溶于其中,导致液体呈黄色 G F H D E C 13
【解析】
Ⅰ(1)仪器E的名称是分液漏斗,B是冷凝管,由B的使用可知SO2与氯气之间的反应属于放热反应,B处反应管冷却水是下进上出,因此应从a接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是该反应为放热反应,降温有利于平衡正向移动,有利于SO2的生成。
(2)甲装置主要是制二氧化硫气体,因此试剂X、Y的组合最好是c。
(3)戊是贮气装置,储存氯气,因此将饱和食盐水加入,氯气进入到丙中,因此E中的试剂是饱和食盐水;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应生成盐酸和硫酸。
(4)先根据生成沉淀的质量计算SO2Cl2的质量,再计算百分含量。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,主要是久置后SO2Cl2分解生成Cl2,溶于其中,导致液体呈黄色。
Ⅱ(1)A应该是电解池的阴极,生成氢气,B为阳极,生成氯气,因此得出仪器接口的连接顺序。
(2)根据方程式的比例关系计算氢氧根的物质的量,再计算氢氧根浓度,再计算pH值。
Ⅰ(1)仪器E的名称是分液漏斗,B是冷凝管,由B的使用可知SO2与氯气之间的反应属于放热反应,B处反应管冷却水是下进上出,因此应从a接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是该反应为放热反应,降温有利于平衡正向移动,有利于二氯化砜的生成,故答案为:分液漏斗;放;a;该反应为放热反应,降温有利于平衡正向移动,有利于二氯化砜的生成。
(2)甲装置主要是制二氧化硫气体,因此试剂X、Y的组合最好是c;故答案为c。
(3)戊是贮气装置,储存氯气,因此将饱和食盐水加入,氯气进入到丙中,因此E中的试剂是饱和食盐水;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:饱和食盐水;SO2+Cl2+2H2O=H2SO4+2HCl。
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g;
SO2Cl2——BaSO4
135g 233g
xg 1.5g
![]()
解得x=0.869g
![]() ,故答案为86.9%。
,故答案为86.9%。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,主要是久置后SO2Cl2分解生成Cl2,因此其原因是SO2Cl2 久置后分解产生Cl2,溶于其中,导致液体呈黄色,故答案为:SO2Cl2 久置后分解产生Cl2,溶于其中,导致液体呈黄色。
Ⅱ(1)A应该是电解池的阴极,生成氢气,B为阳极,生成氯气,因此仪器接口的连接顺序是A接G,F接H;B接D,E接C,故答案为:G;F;H;D;E;C。
(2)
根据 H2——2NaOH
22.4L 2mol
0.112L xmol
![]()
解得x = 0.01mol
![]() ,因此pH=13,故答案为:13。
,因此pH=13,故答案为:13。

 阅读快车系列答案
阅读快车系列答案