题目内容
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
【答案】A
【解析】
A.电池充电时负极与外电源的负极相连;
B.向外供电时,该装置是原电池,锂离子向正极移动;
C.该电池充电时阴极得电子,发生还原反应;
D.根据电极反应计算消耗Li的质量。
A.电池充电时负极与外电源的负极相连,Li为负极反应物,所以Li与外电源的负极相连,故A正确;
B.向外供电时,该装置是原电池,锂离子向正极移动,故B错误;
C.该电池充电时阴极得电子,发生还原反应,电极反应为:![]() ,故C错误;
,故C错误;
D.若放电时转移0.2mol电子,负极上![]() ,所以反应消耗Li的质量为0.2mol×7g/mol=1.4g,故D错误;
,所以反应消耗Li的质量为0.2mol×7g/mol=1.4g,故D错误;
故答案选:A。

【题目】X、Y、Z、M、R五种元素的原子序数依次增大,只有X、Y、Z为短周期元素,相关信息如表:
元素 | 相关信息 |
X | 基态原子核外有3个能级,且各能级电子数目相等 |
Y | 常见化合价只有0、-1、-2 |
Z | 单质为黄绿色有毒气体 |
M | 第四周期d区元素,基态原子的核外有6个未成对电子 |
R | 第五周期,与X处于同一主族 |
(1)元素X、Y电负性的大小顺序是______(用元素符号表示)。
(2)XYZ2分子中所有原子均满足8电子构型,分子中σ键与π键的数目比为______。
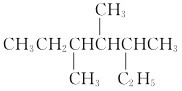
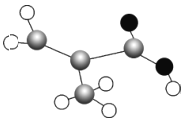
(3)元素Y可形成一种氢化物的空间结构如图所示,中心原子Y的杂化方式是______,该分子为______(填“极性”或“非极性”)分子。
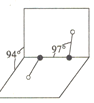
(4)元素M基态原子的价电子排布式为______,MO5中M的化合价为+6价,则该分子中含有过氧键的数目为______。
(5)元素R与Z可形成化合物RZ2,用价层电子对互斥理论推断该分子的空间构型为______,分子中Z-R-Z的键角______120°(填“>”、“=”或“<”)。
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。