题目内容
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:
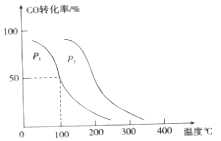
①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
【答案】2CH4(g)+O2(g)2CH3OH(g)△H=-251.2KJ/mol < V2/a2 CH3OH-6e-+8OH-=CO32-+6H2O 1.6g >
【解析】
(1)依据热化学方程式和盖斯定律计算得到;
(2)①依据反应是气体体积减小的反应,铜温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为50%,结合平衡三段式列式计算平衡浓度结合平衡常数概念计算得到;
(3)甲醇燃料电池中电解质溶液为KOH(或NaOH),燃料甲醇在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;依据电子守恒分析计算消耗的CH3OH的质量;
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则HCO3-水解大于电离;
(1)![]()
![]()
![]() 依据盖斯定律
依据盖斯定律
① +②2×③得到:![]()
故答案为:![]() ;
;
(2)①图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;
②向VL恒容密闭容器中充入amolCO与2amolH2,100℃时一氧化碳的转化率为50%,依据平衡三段式列式计算
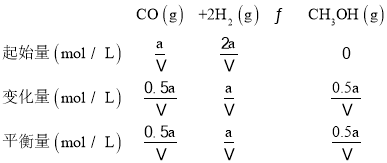
平衡常数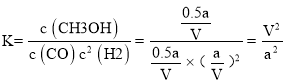 ,
,
故答案为:![]() ;
;
(3)甲醇燃料电池中电解质溶液为碱液,燃料甲醇在负极失电子发生氧化反应,电极反应为![]() ,正极上是氧气得到电子发生还原反应,电极反应为
,正极上是氧气得到电子发生还原反应,电极反应为![]() ;用该电池电解氯化钠溶液,当得到3.36L氢气物质的量为
;用该电池电解氯化钠溶液,当得到3.36L氢气物质的量为![]() 时,电极反应为
时,电极反应为![]() ,依据电子守恒可知,
,依据电子守恒可知,![]() ,燃料电池所消耗的CH3OH的质量为:
,燃料电池所消耗的CH3OH的质量为:![]() ;
;
故答案为:![]() ;1.6g;
;1.6g;
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则HCO3-水解大于电离,根据电离方程式和水解方程式![]() ,
,![]() ,可知c(H2CO3)>c(CO32-),
,可知c(H2CO3)>c(CO32-),
故答案为:>。

 阅读快车系列答案
阅读快车系列答案