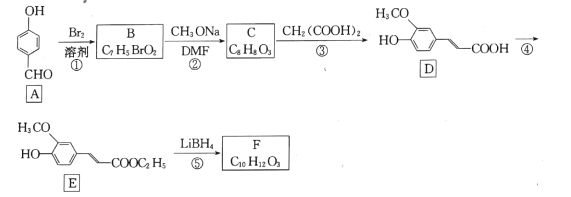
题目内容
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。
【答案】285.8kJ/mol 2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol B D 0.12mol/(L·s) 0.25 降温使氨成为液体,与氨气和氢气分离开
【解析】
(1) 101kPa下,1g即0.5molH2完全燃烧生成液态水放出142.9kJ热量,则1mol H2完全燃烧生成液态水放出142.9kJ×2=285.8 kJ热量,即氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol;
(2)
①中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中,所以B正确;
②A.温度计用于测定温度,不能使用温度计搅拌溶液,A错误;
B.揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,B错误;
C.轻轻地振荡烧杯,会导致溶液溅出,甚至导致热量散失,影响测定结果,C错误;
D.用套在温度计上的环形玻璃棒轻轻地搅动,可以使硫酸和氢氧化钠溶液混合均匀,又可以减少热量散失,D正确;故选D。
(3)10s内,生成NH3的物质的量为1.6mol,此时消耗H2的物质的量为![]() mol=2.4mol,根据化学反应速率表达式,v(H2)=
mol=2.4mol,根据化学反应速率表达式,v(H2)=![]() = 0.12mol/(L·s);达到平衡时,n(NH3)=2mol,n(H2)=4mol,n(N2)=1mol,根据平衡常数表达式K=
= 0.12mol/(L·s);达到平衡时,n(NH3)=2mol,n(H2)=4mol,n(N2)=1mol,根据平衡常数表达式K=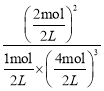 =0.25;NH3易液化,可以采用降温使NH3成为液体,与N2和H2分离开。
=0.25;NH3易液化,可以采用降温使NH3成为液体,与N2和H2分离开。