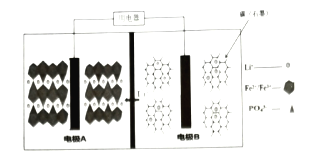
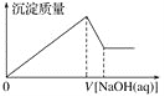
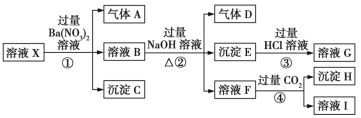
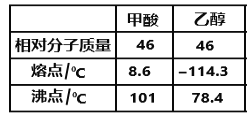
题目内容
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
【答案】Al>C>N>O>H 2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O 3H++ Al(OH)3= Al3++3H2O 34 H2SeO4
CaCl2 + 2NH3↑+2H2O 3H++ Al(OH)3= Al3++3H2O 34 H2SeO4
【解析】
X、Y、Z、L、M五种短周期元素的原子序数依次增大,X是原子半径最小的元素,则X为H元素;Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,则Z为N元素;Y的最高正价和最低负价的代数和为0,Y为第ⅣA族,为C元素;M是地壳中含量最高的金属元素,则M为Al元素;L的最外层电子数是次外层的3倍,最外层有6个电子,为O元素,据此分析解答。
根据上述分析,X为H元素;Y为C元素,Z为N元素,L为O元素,M为Al元素。
(1)同周期自左而右,原子半径减小、同主族自上而下,原子半径增大,所有元素中H原子半径最小,故原子半径:Al>C>N>O>H,故答案为:Al>C>N>O>H;
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C,其中B为氨气,实验室制取氨气的化学方程式为2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O;
CaCl2 + 2NH3↑+2H2O;
(3)Z的最高价氧化物对应水化物为硝酸,M的最高价氧化物对应水化物为氢氧化铝,二者反应生成硝酸铝和水,反应的离子方程式为3H++ Al(OH)3= Al3++3H2O,故答案为:3H++ Al(OH)3= Al3++3H2O;
(4)L为O元素,Se与O同一主族,Se原子比O原子多两个电子层,则Se的原子序数为8+8+18=34,其最外层电子数为6,则最高化合价为6,最高价氧化物对应的水化物化学式为H2SeO4,故答案为:34;H2SeO4。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。