题目内容
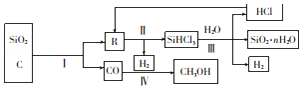
【题目】关于硫酸工业中的催化氧化反应,叙述正确的是( )
A.是吸热反应B.在常压下进行
C.在沸腾炉中进行D.使用铁触媒作催化剂
【答案】B
【解析】
A.硫酸工业中的催化氧化反应是放热反应,A选项错误;
B.硫酸工业中的催化氧化反应选择在常压下进行,B选项正确;
C.硫酸工业中的催化氧化反应是在接触室中发生反应,C选项错误;
D.硫酸工业中的催化氧化反应使用V2O5作催化剂,D选项错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】草酸与高锰酸钾在酸性条件下能够发生反应:MnO4+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
实验编号 | A溶液 | B溶液 |
① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l1mol/L酸性KMnO4溶液 |
② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.01 mol/L酸性KMnO4溶液 |
(1)该反应中氧化剂和还原剂的物质的量之比为 .
(2)该实验探究的是对反应速率的影响.实现该实验目的还欠缺的仪器: . 比较①、②两组化学反应速率大小的方法是 .
乙组方案:用4mL0.0l1mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | ﹣ |
Ⅱ | 2 | 20 | 少量MnSO4粉末 |
Ⅲ | 2 | 30 | ﹣ |
Ⅳ | 1 | 20 | 1mL蒸馏水 |
(3)若要研究催化剂对化学反应速率的影响,则应对比实验(填序号,下同);若要研究温度对化学反应速率的影响,则应对比实验 .
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 .