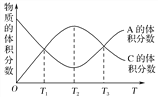
题目内容
【题目】17克NH3共有mol原子,0.1molH2S共有个氢原子;同质量的NH3和H2S中分子个数比为 . 在标准状况下,35.5g氯气的体积是 L,将其与氢气完全化合,需氢气的物质的量是mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是molL﹣1 , 将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是molL﹣1 .
【答案】4;0.2NA;2:1;11.2;0.5;1;0.1
【解析】解:n(NH3)= ![]() =1mol,所含原子的物质的量为4mol; 0.1molH2S共有0.2NA个氢原子;
=1mol,所含原子的物质的量为4mol; 0.1molH2S共有0.2NA个氢原子;
由n= ![]() =
= ![]() 可知:N(NH3):N(H2S)=
可知:N(NH3):N(H2S)= ![]() :
: ![]() =2:1;
=2:1;
n(Cl2)= ![]() =0.5mol,V(Cl2)=0.5mol×22.4L/mol=11.2L;
=0.5mol,V(Cl2)=0.5mol×22.4L/mol=11.2L;
由反应Cl2+H2=2HCl可知:需氢气的物质的量是0.5mol;
c(HCl)= ![]() =1mol/L;
=1mol/L;
将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是 ![]() =0.1mol/L.
=0.1mol/L.
所以答案是:4;0.2NA;2:1;11.2L;0.5;1;0.1.

 阅读快车系列答案
阅读快车系列答案【题目】硫酸亚铁加热至高温会分解,生成—种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
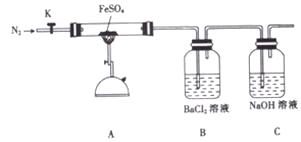
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却。
(1)已知M中铁元素的质量分数为70%,M的化学式为_____________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
操作步骤 | 实验现象 | 用方程式解释原因 |
打开K,通入一段时间N2,关闭K。加热A中玻璃管一段时间 | 洗气瓶B中①__________ | ②______________ |
A中固体不再分解后,停止加热,打开K,缓慢通入N2至玻璃管冷却 | 硬质玻璃管最终可以看到③_______________ | ④______________ |
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
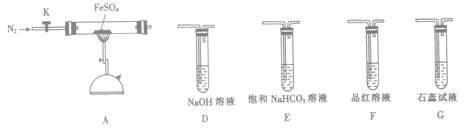
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→______→______。
②能证明生成了非金属氧化物N的现象是________________。