��Ŀ����
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���Ա�������ĸ�����Ԫ�أ��ش��������⣺ 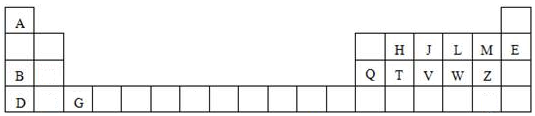
��1��ԭ�Ӱ뾶����Ԫ�������ڻ�������ֻ�и��۵�Ԫ���������ڸ���Ԫ�������ʺ����뵼����ϵ��� �� ��ֻ�ñ��е���ĸ��д��
��2��V�����ڱ��е�λ�õ����ڵ��壮
��3��A��MԪ���γɵĻ������������D��Zԭ���γɵĻ�ѧ��������
��4��J��H��T����Ԫ�ص���ۺ������������ǿ������˳���������û�ѧʽ��ʾ��
��5��LԪ���γɵ��⻯����ک�4��ʱ�����壨������ͣ������ܶȱȶ�Ӧ��Һ̬��С���ʹ�����������ԭ���� ��
��6��д��B��Q����Ԫ�ص��������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��D��M��G��T
��2������VA
��3�����ۣ�����
��4��HNO3��H2CO3��H2SiO3����H4SiO4��
��5�����ӣ�����֮�仹�ܲ������
��6��NaOH+Al��OH��3=NaAlO2+2H2O
���������⣺��1��ͼʾ���ڱ���D��G�ĵ��Ӳ���࣬����ԭ�Ӱ뾶�ϴ�����D�ĺ˵������С����ԭ�Ӱ뾶����ΪD��F��M���ķǽ�������ǿ�����ڻ�������ֻ�и��ۣ����ڱ���λ�ڽ�����ǽ������紦��Ԫ�ؿ����뵼����ϣ����ʺ����뵼����ϵ���T��Si�������Դ��ǣ�D��M��G��T����2������ͼʾ��֪��VΪPԪ�أ�λ�����ڱ��е�������VA�壬���Դ��ǣ�����VA����3��AΪH��MΪFԪ�أ�H��F�γɵĻ�����HFΪ���ۻ����D��Z�ֱ�ΪK��ClԪ�أ������γɵĻ�����ΪKCl���Ȼ���Ϊ���ӻ�������Դ��ǣ����ۣ����ӣ���4��J��H��T�ֱ�ΪN��C��SiԪ�أ��ǽ����ԣ�N��C��Si��������������Ӧˮ���������ǿ��Ϊ��HNO3��H2CO3��H2SiO3����H4SiO4�������Դ��ǣ�HNO3��H2CO3��H2SiO3����H4SiO4������5��LԪ��ΪO��O���⻯��Ϊˮ��ˮ�����γɵľ���Ϊ���Ӿ��壻���ڷ���֮�仹�ܲ������������ˮ�ڹ�̬ʱ���ܶȱȶ�Ӧ��Һ̬��С�����Դ��ǣ����ӣ�����֮�仹�ܲ����������6��B��Q�ֱ�ΪN��Al������Ԫ�ص��������Ӧ��ˮ����ֱ�ΪNaOH��Al��OH��3 �� ��������������������Ӧ�Ļ�ѧ����ʽΪ��NaOH+Al��OH��3=NaAlO2+2H2O�� ���Դ��ǣ�NaOH+Al��OH��3=NaAlO2+2H2O��

 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�����Ŀ����ͬ���ʵ���Һ����Բ�ͬ�������±���pH������жϣ�����˵���в���ȷ���ǣ� ��
���� | CuSO4��Һ | NaCl��Һ | ˮ | Na2CO3��Һ | NaOH��Һ | |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
A.����Һһ��������
B.�Լ��Ե���Һ��һ���Ǽ���Һ
C.����Һһ��������
D.����Һ��һ��������

