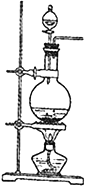
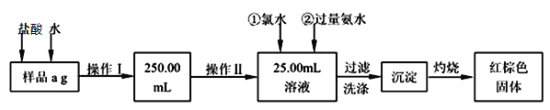
题目内容
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
【答案】△H1+2△H2 n(O3):n(NO)<1,臭氧氧化NO为NO2,NO减少,NO2增多;n(O3):n(NO)>1,臭氧过量把NO2转化成更高价态 SO2与O3的反应速率慢 0.05mol(L·min)-1 a 减小 ![]()
【解析】
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)①NO(g)+O3(g)=NO2(g)+O2(g) △H1;②NO(g)+1/2O2(g)=NO2(g) △H2;由盖斯定律,①+2×②可得:3NO(g)+O3(g)═3NO2(g),则△H=△H1+2△H2;
(2)①n(O3):n(NO)<1,臭氧氧化NO为NO2,NO减少,NO2增多;n(O3):n(NO)>1,臭氧过量把NO2转化成更高价态;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是SO2与O3的反应速率慢;
(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),
①5min时,测得容器中SO3(g)的物质的量为0.5mol,则消耗SO2(g)的物质的量为0.5mol,0-5min内,用SO2表示的平均反应速率v(SO2)=![]() ;
;
②a. 单位时间内生成nmolSO2同时生成nmolSO3,表示的是正逆反应速率,且满足二者的化学计量数关系,说明正逆反应速率相等,达到平衡状态,故正确;b. 各物质分子数之比等于多少决定于开始加入的各物质的多少,与化学反应是否处于平衡状态无关,不能说明反应达到平衡状态,故错误;c.混合气体物质的量不变,恒温恒容下,容器内压强为定值,不能说明反应达到平衡状态,故错误;d. 容器容积不变,气体的体积不变,反应两边都是气体,气体的总质量不变,根据ρ=![]() ,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故错误;e.反应为气体体积不变的反应,在反应的任何阶段,总质量没变,总的气体分子数没变,所以平均相对分子质量不会变,不能说明反应达到平衡状态,故错误;答案选a;
,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故错误;e.反应为气体体积不变的反应,在反应的任何阶段,总质量没变,总的气体分子数没变,所以平均相对分子质量不会变,不能说明反应达到平衡状态,故错误;答案选a;
(4)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。 由图分析可知,反应温度升高,O2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小;
(5)根据反应离子方程式ClO2-+2SO32-![]() 2SO42-+Cl-可知平衡常数K表达式为K=
2SO42-+Cl-可知平衡常数K表达式为K=![]() 。
。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
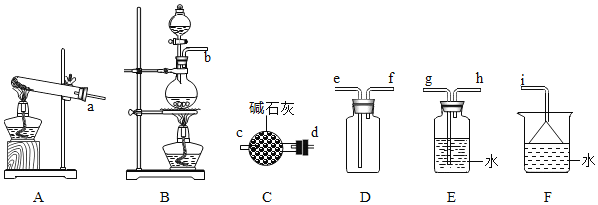
(2)氨气的发生装置可以选择上图中的________,反应的化学方程式为_______________。
(3)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_________(按气流方向,用各接口小写字母表示)。
(4)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
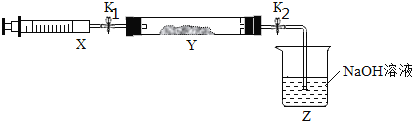
在一定温度下按上图所示装置进行实验。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | Y管中______ | 反应的化学方程式:___ |
将注射器活塞退回原处并固定,将装置恢复到室温 | Y管中有少量水珠 | 生成的气态水冷凝 |
打开K2 | _________ | ________ |