题目内容
(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有 (填序号,以下同),含有金属离子的物质是 ,分子间可形成氢键的物质是 ,属于离子晶体的是 ,属于原子晶体的是 ,①~⑤五种物质的熔点由高到低的顺序是 .
(2)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A. ;B. ;C. ;D. .
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A. ;B. ;C. ;D. .
(2)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A.
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.

考点:极性键和非极性键,共价键的形成及共价键的主要类型,含有氢键的物质,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)根据组成元素及微粒之间的化学键分析;根据晶体的熔点:原子晶体>离子晶体>金属晶体>分子晶体;
(2)根据晶体的物理性质分析;
(3)根据晶体结构模型判断物质的种类.
(2)根据晶体的物理性质分析;
(3)根据晶体结构模型判断物质的种类.
解答:
解:(1)①CO2 ⑤CS2中只含有极性键,分子都是直 线形分子,正负电荷中心重合,属于非极性分子;
②NaCl是由钠离子和氯离子构成,③Na是由钠离子和自由电子构成,都含有金属离子;
⑧乙醇乙醇中中羟基氢一羟基上的氧原子能形成氢键;
②NaCl ⑦(NH4)2SO4都是由阴、阳离子构成的离子晶体;
④Si ⑥金刚石都是由原子构成的原子晶体;
晶体的熔点:原子晶体>离子晶体>金属晶体>分子晶体,Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,Na的熔点低于100℃,所以熔点高到低的顺序为:④>②>③>⑤>①;
故答案为:①⑤;②③;⑧;②⑦;④⑥;④>②>③>⑤>①;
(2)A.固态时能导电,能溶于盐酸,属于金属晶体;
B.能溶于CS2,不溶于水,属于分子晶体;
C.固态时不导电,液态时能导电,可溶于水,属于离子晶体;
D.固态、液态时均不导电,熔点为3 500℃,属于原子晶体;
故答案为:金属晶体、分子晶体、离子晶体、原子晶体;
(3)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石(或晶体硅),
故答案为:氯化铯;氯化钠;二氧化硅;金刚石(或晶体硅).
②NaCl是由钠离子和氯离子构成,③Na是由钠离子和自由电子构成,都含有金属离子;
⑧乙醇乙醇中中羟基氢一羟基上的氧原子能形成氢键;
②NaCl ⑦(NH4)2SO4都是由阴、阳离子构成的离子晶体;
④Si ⑥金刚石都是由原子构成的原子晶体;
晶体的熔点:原子晶体>离子晶体>金属晶体>分子晶体,Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,Na的熔点低于100℃,所以熔点高到低的顺序为:④>②>③>⑤>①;
故答案为:①⑤;②③;⑧;②⑦;④⑥;④>②>③>⑤>①;
(2)A.固态时能导电,能溶于盐酸,属于金属晶体;
B.能溶于CS2,不溶于水,属于分子晶体;
C.固态时不导电,液态时能导电,可溶于水,属于离子晶体;
D.固态、液态时均不导电,熔点为3 500℃,属于原子晶体;
故答案为:金属晶体、分子晶体、离子晶体、原子晶体;
(3)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石(或晶体硅),
故答案为:氯化铯;氯化钠;二氧化硅;金刚石(或晶体硅).
点评:本题考查了晶体的有关性质,主要考查了晶体类型的判断及晶体的物理性质,侧重考查学生分析问题、解决问题的能力,题目难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
霉酚酸是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )
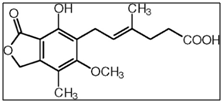

| A、分子式为:C17H18O6 |
| B、处于同一平面的碳原子至多9个 |
| C、不能与FeCl3溶液发生显色反应 |
| D、一定条件下1mol霉酚酸最多可与3mol NaOH反应 |
下列化学方程式或离子方程式正确的是( )
| A、常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O |
| B、向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| C、向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ |
| D、向浓硫酸中加入少量锌:Zn+2H+=Zn2++H2↑ |
2009年5月25日朝鲜进行二次核试验遭到了世界人民的强烈谴责,朝鲜因拥有丰富的铀矿而具有进行核能研究的天然条件.下列有关铀元素的说法中,错误的是( )
| A、234U、235U、238U是3种原子 | ||
B、
| ||
C、
| ||
D、
|
本世纪初,由各国科学家组成的科研小组合成了非常罕见的
Fe原子,你认为关于
Fe的说法中错误的是( )
45 26 |
45 26 |
| A、它位于元素周期表中的第4周期Ⅷ族 | ||||
B、
| ||||
| C、它在氧气中燃烧时失去电子 | ||||
| D、它可表现为+2或+3价 |