题目内容
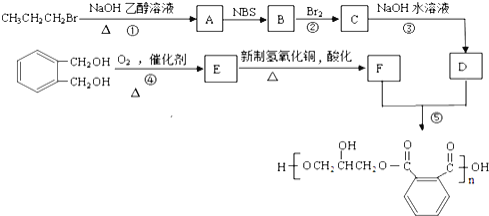
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。图1是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
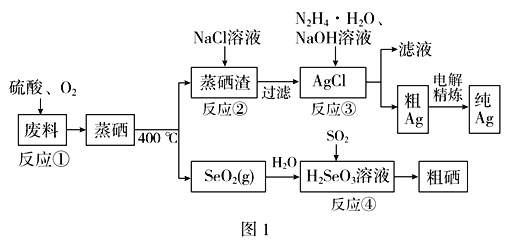
(1)为提高反应①的浸出速率,可采取的措施为______________(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式__________。
(3)反应②为Ag2SO4(s)+2Cl-(aq)![]() 2AgCl(s)+
2AgCl(s)+![]() (aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq)
(aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化学平衡常数的数量级为________。
(aq)的化学平衡常数的数量级为________。
(4)写出反应④的化学方程式________________________________________。
(5)室温下,H2SeO3水溶液中H2SeO3、![]() 、
、![]() 的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。

【答案】加热、增大硫酸的浓度、粉碎固体废料、搅拌等 4AgCl+N2H4·H2O+4OH-=4Ag+4Cl-+N2↑+5H2O (或4AgCl+N2H4+4OH-=4Ag+4Cl-+N2↑+4H2O) 1014 H2SeO3+2SO2+H2O=2H2SO4+Se↓(或H2SeO3+2H2SO3=2H2SO4+Se↓+H2O) 10-7.3
【解析】
(1)从影响化学反应速率的外界因素进行分析;
(2)反应③中AgCl转化为Ag,Ag的化合价降低,则N2H4·H2O中N的化合价升高,结合题意知N2H4·H2O转化为N2;
(3)Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化学平衡常数为K=
(aq)的化学平衡常数为K=![]() ;
;
(4)反应④为SO2和H2SeO3的反应,H2SeO3转化为Se,H2SeO3被还原,则SO2被氧化,SO2转化为H2SO4,根据得失电子守恒和原子守恒,写出化学方程式;
(5)根据题图3,可知pH=7.30时,HSeO![]() 、SeO
、SeO![]() 的物质的量分数相等计算;
的物质的量分数相等计算;
(1)根据外界条件对反应速率的影响,为了提高浸出速率,可以采取的措施有加热、增大硫酸的浓度、粉碎固体废料、搅拌等;
答案:加热、增大硫酸的浓度、粉碎固体废料、搅拌等
(2)反应③中AgCl转化为Ag,Ag的化合价降低,则N2H4·H2O中N的化合价升高,结合题意知N2H4·H2O转化为N2,反应的离子方程式为:4AgCl+N2H4·H2O+4OH-=4Ag+4Cl-+N2↑+5H2O (或4AgCl+N2H4+4OH-=4Ag+4Cl-+N2↑+4H2O);
答案:4AgCl+N2H4·H2O+4OH-=4Ag+4Cl-+N2↑+5H2O (或4AgCl+N2H4+4OH-=4Ag+4Cl-+N2↑+4H2O)
(3)根据题图2,可以计算出Ksp(AgCl)=c(Ag+)·c(Cl-)=10-5×10-4.75=10-9.75,Ksp(Ag2SO4)=c2(Ag+)·c(SO![]() )=(10-2)2×10-1=10-5。该反应的平衡常数K=
)=(10-2)2×10-1=10-5。该反应的平衡常数K=![]() ==
==![]() =
= ![]() = 1014.5=100.5×1014,1<100.5<10,故该反应的化学平衡常数的数量级为1014;
= 1014.5=100.5×1014,1<100.5<10,故该反应的化学平衡常数的数量级为1014;
答案:1014
(4)反应④为SO2和H2SeO3的反应,H2SeO3转化为Se,H2SeO3被还原,则SO2被氧化,SO2转化为H2SO4,根据得失电子守恒和原子守恒,配平化学方程式为:H2SeO3+2SO2+H2O=2H2SO4+Se↓;
答案:H2SeO3+2SO2+H2O=2H2SO4+Se↓(或H2SeO3+2H2SO3=2H2SO4+Se↓+H2O)
(5)根据题图3,可知pH=7.30时,HSeO![]() 、SeO
、SeO![]() 的物质的量分数相等,即c(HSeO
的物质的量分数相等,即c(HSeO![]() )=c(SeO
)=c(SeO![]() ),则H2SeO3的Ka2=
),则H2SeO3的Ka2= ![]() =c(H+)=10-7.3;
=c(H+)=10-7.3;
答案:10-7.3

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
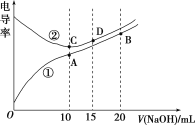
小学期末冲刺100分系列答案【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。