题目内容
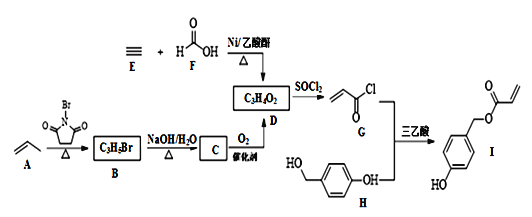
【题目】常温下,在10 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
A.溶液的pH为7时,溶液的总体积大于20 mL
B.在B点所示的溶液中:c(Na+)+c(H+) =2c(![]() )+c(
)+c(![]() )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
C.在A点所示的溶液中: c(Na+)=c(![]() )=c(
)=c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(![]() )时,溶液的pH=10
)时,溶液的pH=10
【答案】C
【解析】
A.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故不选A;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+) =2c(![]() )+c(
)+c(![]() )+c(OH-)+c(Cl-),故不选B;
)+c(OH-)+c(Cl-),故不选B;
C.根据图象分析,A点为碳酸钠,碳酸氢钠、氯化钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故选C;
D.根据Kh=![]() 计算可得c(OH-)=10-4,因此溶液的pH=10,故不选D;
计算可得c(OH-)=10-4,因此溶液的pH=10,故不选D;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①己知该反应可以自发进行,则△
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。