题目内容
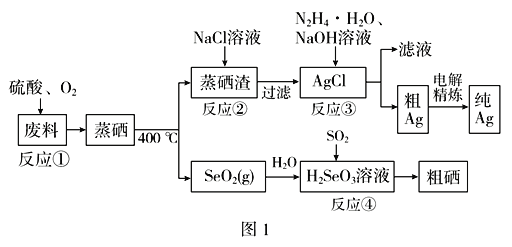
【题目】氨在人类的生产和生活中有着广泛的应用。利用下图装置某化学兴趣小组在实验室制备氨气并进行氨的催化氧化实验。
I制备并收集干燥的氨气
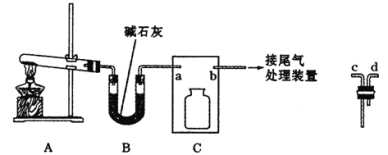
(1)A中反应的化学方程式为________。
(2)B装置的作用为_____,C装置用于收集氨气,则装置中导管的连接顺序为a→__→__→b。
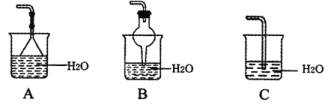
(3)氨气的尾气处理装置不能选用___(填写代号)。
II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:

(4)氨的催化氧化反应的化学方程式为_______。
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是___反应(填“吸热”或“放热”)。
(6)锥形瓶内的实验现象为_____。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O 干燥氨气 d c C 4NH3 + 5O2
CaCl2+2NH3↑+2 H2O 干燥氨气 d c C 4NH3 + 5O2  4NO+6H2O 放热 锥形瓶内产生红棕色气体
4NO+6H2O 放热 锥形瓶内产生红棕色气体
【解析】
实验室常用固体氯化铵和氢氧化钙加热反应制取氨气,再经过干燥,收集氨气时要用向下排空气法收集,氨气极易溶于水,因此再处理尾气时要防倒吸;氨气与氧气在催化剂作用下反应,该反应是放热反应。
⑴A中是固体和固体加热条件下反应,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O;故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2 H2O;故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O。
CaCl2+2NH3↑+2 H2O。
⑵B装置盛装碱石灰,其作用为干燥氨气,C装置用于收集氨气,氨气的密度比空气轻,需要短进长出,因此装置中导管的连接顺序为a→d→c→b;故答案为:干燥氨气;d;c。
⑶氨气极易溶于水,要防倒吸,因此氨气的尾气处理装置不能选用C;故答案为:C。
⑷氨的催化氧化生成一氧化氮和水,其反应的化学方程式为4NH3 + 5O2  4NO+6H2O;故答案为:4NH3 + 5O2
4NO+6H2O;故答案为:4NH3 + 5O2  4NO+6H2O。
4NO+6H2O。
⑸锥形瓶内铂丝始终保持红热状态,说明该反应是放热反应;故答案为:放热。
⑹锥形瓶内生成NO,NO和氧气反应生成NO2,因此实验现象为锥形瓶内产生红棕色气体;故答案为:锥形瓶内产生红棕色气体。