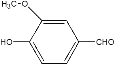
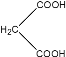
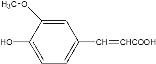
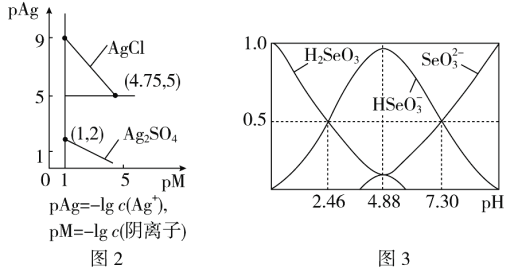
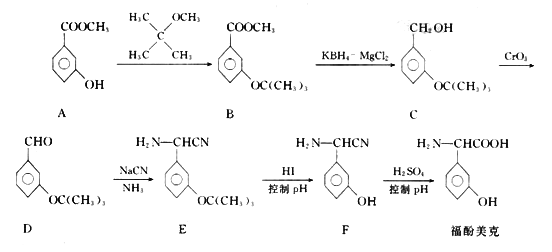
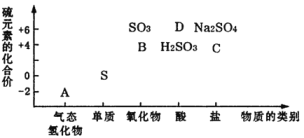
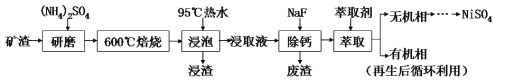
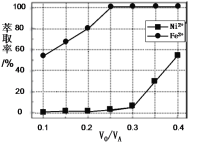
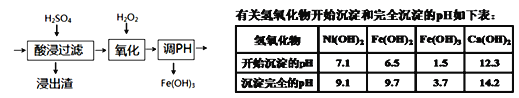
题目内容
【题目】A,B,C为第2或第3周期的元素,A、B在同周期,A、C阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是
A.原子核外最外层电子数:A > C > BB.离子半径:A2-> C-> B2+
C.B和C形成的化合物电子式为B2+[ C ]![]() D.稳定性:H2A > HC
D.稳定性:H2A > HC
【答案】B
【解析】
A、B、C为第2或第3周期的元素,B2+与C-具有相同的电子层结构,B为Mg,C为F;A、B在同周期,A、C的阴离子分别为A2-和C-,A为S,据此分析作答。
A、B、C为第2或第3周期的元素,B2+与C-具有相同的电子层结构,B为Mg,C为F;A、B在同周期,A、C的阴离子分别为A2-和C-,A为S;
A项,A、B、C的最外层电子数依次为6、2、7,原子核外最外层电子数:C>A>B,A项错误;
B项,S2-有3个电子层,Mg2+和F-都为2个电子层,Mg2+和F-具有相同的电子层结构,根据“层多径大、序大径小”,离子半径:A2->C->B2+,B项正确;
C项,B和C形成的化合物电子式为![]() ,C项错误;
,C项错误;
D项,非金属性:F>S,稳定性:H2A<HC,D项错误;
答案选B。

【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
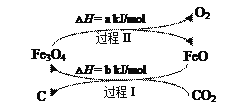
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①己知该反应可以自发进行,则△
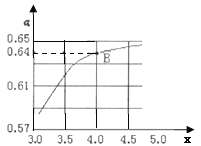
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。