题目内容
5.未知物A的实验式和分子式都是C2H6O.A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰如图(b),峰面积之比是1:2:3,未知物A的结构简式为CH3-CH2-OH.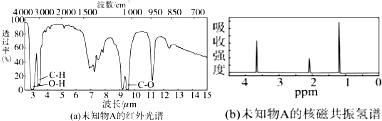
分析 A的核磁共振氢谱有3个峰,说明分子中有3种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目,结构简式.
解答 解:据题意知:有三种峰,说明氢原子有三种情况,峰面积之比是1:2:3,说明这三种氢的个数之比为1:2:3,分子式为:C2H6O,故结构简式为:CH3-CH2-OH,故答案为:CH3-CH2-OH.
点评 本题考查有机物分子式的确定,题目难度较大,本题易错点为根据谱图写出符合条件的结构简式.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
15.下列对实验现象的解释与结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42- |
| B | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| C | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了盐析 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
16.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀H2SO4的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 浓硫酸的稀释 |
13.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃,pH=12的氨水和pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
20.在某温度下,将20g苯乙烯(C6H5CH=CH2)溶于30g苯中,所得混合溶液中,碳元素的质量分数是( )
| A. | 92.1% | B. | 84.6% | C. | 92.3% | D. | 84.2% |
10.A、B、C是周期表中相邻的三种元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A、B、C三种元素是( )
| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
17.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: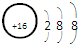 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: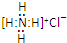 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+5 |
14.下列变化过程中,一定发生了化学变化的是( )
| A. | 蒸馏 | B. | 升华 | C. | 爆炸 | D. | 燃烧 |
16.X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是( )
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 |