题目内容
13.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃,pH=12的氨水和pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.根据NaHA溶液中的物料守恒分析;
B.混合液中氨水过量,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可得:c(NH4+)>c(Cl-);
C.水的离子积与温度有关,温度不变,则水的离子积不变;
D.NH4HSO4溶液中加入等物质的量的NaOH,反应后溶液的溶质为硫酸钠和硫酸铵,溶液呈酸性,结合电荷守恒、盐的水解原理判断各离子浓度大小.
解答 解:A.二元弱酸酸式盐NaHA溶液中存在物料守恒,应为c(Na+)=c(A2-)+c(HA-)+c(H2A),故A错误;
B.25℃,pH=12的氨水和pH=2的盐酸溶液等体积混合,氨水为弱碱,则混合液中氨水过量,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可得:c(NH4+)>c(Cl-),正确的离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.将pH=5的醋酸溶液稀释后,恢复至原温度,溶液中氢离子浓度减小,则溶液的pH增大,由于温度不变,则水的离子积Kw不变,故C错误;
D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液,反应后溶液的溶质为硫酸钠和硫酸铵,由于NH4+水解,溶液呈酸性,则有c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,侧重考查学生分析问题的能力,注意把握弱电解质的电离和盐类水解的特点,注意电荷守恒、物料守恒、以及质子守恒的运用.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
3.Cyrneine A对治疗神经系统疾病有着很好的疗效,其可以用香芹酮经过多步反应合成:

则下列有关的说法正确的是( )

则下列有关的说法正确的是( )
| A. | 香芹酮化学式为C9H12O,其一氯代物有12种 | |
| B. | 香芹酮分子中有8种不同化学环境的氢 | |
| C. | Cyrneine A可以发生加成反应、氧化反应、酯化反应等,但不能发生消去反应 | |
| D. | 香芹酮和Cyrneine A均能够使溴水和酸性KMnO4溶液褪色 |
4.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 氯化铵与乙醇分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
1.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A. | 第1列中的碱金属和第17列元素的单质熔、沸点变化趋势相同 | |
| B. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| C. | 在整个18列元素中,第14列元素形成的化合物种类最多 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
18.下列烷烃分子中的一个氢原子被氯原子取代后,不能产生同分异构体的是( )
| A. | 戊烷 | B. | 2,2-二甲基丙烷 | C. | 异丁烷 | D. | 异戊烷 |
4.下列说法不正确的是( )
| A. | 碳化硅可作砂纸、砂轮的磨料 | |
| B. | 地沟油没有利用价值,可用燃烧法处理 | |
| C. | 食盐、食醋、纯碱、小苏打是常见的厨房用品 | |
| D. | 开发和利用太阳能是节约化石能源,弥补能源不足的途径 |
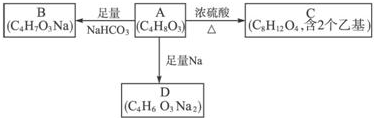
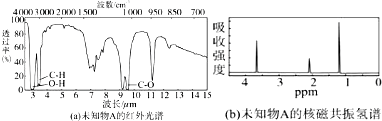
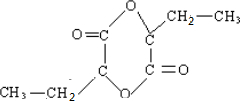 .
.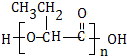 .
.