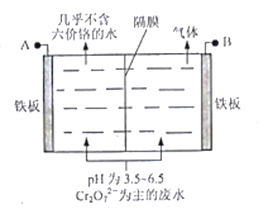
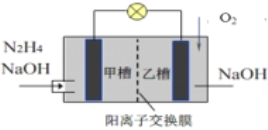
题目内容
【题目】微生物电池工作原理如图所示。下列有关说法错误的是

A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
【答案】D
【解析】A、葡萄糖所在的电极b是负极,氧气所在的电极a是正极,电流方向从a到b ,A正确;B、正极上O2得到电子生成O2-,然后与电解质中的H+结合生成H2O,电极反应为:O2+4e-+4H+=2H2O,B正确;C、C6H12O6中的碳元素的化合价从0价升高到+4价,1molC6H12O6完全反应生成CO2,转移的电子数为4×6mol=24mol,C正确;D、原电池总反应为:C6H12O6+6O2=6CO2+6H2O,没有生成也没有消耗H+,所以电池内部的氢离子物质的量不变,D错误。正确答案为D。

【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度 (mol/L) | 速率 (mol·L-1·s-1) | 物质的平衡浓度 (mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是
A. m=2,n=1
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行