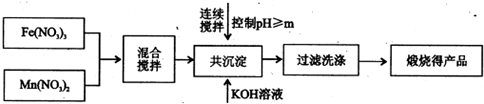
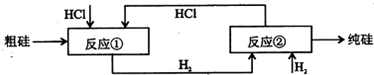
题目内容
(2010?德阳模拟)下列溶液中各微粒的物质的量浓度关系正确的是( )
分析:A.物质的量相等的硫酸氢铵和氢氧化钠恰好反应生成硫酸钠和硫酸铵,铵根离子易水解而使其溶液呈酸性,结合物料守恒分析;
B.在NaHS溶液中HS-既能电离也能水解,但都较微弱,其电离程度小于水解程度而使溶液呈碱性;
C.根据物料守恒和电荷守恒判断;
D.等物质的量浓度的醋酸和醋酸钠溶液中,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度.
B.在NaHS溶液中HS-既能电离也能水解,但都较微弱,其电离程度小于水解程度而使溶液呈碱性;
C.根据物料守恒和电荷守恒判断;
D.等物质的量浓度的醋酸和醋酸钠溶液中,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度.
解答:解:A.物质的量相等的硫酸氢铵和氢氧化钠恰好反应生成硫酸钠和硫酸铵,铵根离子易水解而使其溶液呈酸性,即c(H+)>c(OH-),故A错误;
B.在NaHS溶液中HS-既能电离也能水解,但都较微弱,所以c(HS-)>c(OH-),其电离程度小于水解程度而使溶液呈碱性,所以c(OH-)>c(H+),故B错误;
C.根据物料守恒得c(Na+)=c(H2CO3)+2c(CO32-)+c(HCO3-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-),所以得c(OH-)-c(H+)=c(H2CO3)-c(CO32-),故C正确;
D.等物质的量浓度的醋酸和醋酸钠溶液中,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液呈酸性,则c(OH-)<c(H+),所以c(CH3COO-)>c(Na+),由于醋酸电离导致溶液中c(Na+)>c(CH3COOH),所以得c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D错误;
故选C.
B.在NaHS溶液中HS-既能电离也能水解,但都较微弱,所以c(HS-)>c(OH-),其电离程度小于水解程度而使溶液呈碱性,所以c(OH-)>c(H+),故B错误;
C.根据物料守恒得c(Na+)=c(H2CO3)+2c(CO32-)+c(HCO3-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-),所以得c(OH-)-c(H+)=c(H2CO3)-c(CO32-),故C正确;
D.等物质的量浓度的醋酸和醋酸钠溶液中,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液呈酸性,则c(OH-)<c(H+),所以c(CH3COO-)>c(Na+),由于醋酸电离导致溶液中c(Na+)>c(CH3COOH),所以得c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D错误;
故选C.
点评:本题考查了离子浓度大小的比较,结合物料守恒和电荷守恒来分析解答,难点是D选项,先根据电荷守恒判断钠离子和醋酸根离子浓度大小,再结合弱电解质的电离判断钠离子和醋酸分子浓度相对大小,从而得出结论,难度较大.

练习册系列答案
相关题目