题目内容
反应:Cr2O72—+3SO32—+aH+=2Cr3++3Y+4H2O下列说法不正确的是
| A.Y是SO42— |
| B.a=8 |
| C.Cr2O72—被氧化成Cr3+ |
| D.生成1mol Cr3+时转移的电子数是3×6. 02×1023 |
C
解析试题分析:A、根据元素守恒Y是SO42—,正确;B、根据元素守恒,a=8,正确;C、Cr2O72—被还原成Cr3+,错误;D、生成1mol Cr3+,转移3mol电子,正确。
考点:考查了氧化还原计算。

对于反应:H-+NH3=H2+NH2-,下列说法正确的是
| A.属于置换反应 | B.H-既是氧化剂又是还原剂 |
| C.NH3既是氧化剂又是还原剂 | D.H2既是氧化产物又是还原产物 |
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
| A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性 |
| B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 |
| C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2 |
| D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72- |
已知溶液中:还原性: -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )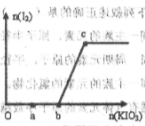
| A.a点时NaHSO3过量 |
| B.b点时还原产物为碘离子 |
| C.b点到c点,KIO3与NaHSO3反应生成单质碘 |
| D.加入的KIO3为0.4mol或1.12mol时,反应后溶液中碘离子均为0.4mol |
在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.25mol·L-1 | B.0.002mol·L-1 | C.0.02mol·L-1 | D.0.2mol·L-1 |
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是
| A.5 | B.4 | C.3 | D.2 |
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色(淀粉遇I2变蓝)。下列判断正确的是
| A.上述实验证明氧化性:MnO4->Cl2 > Fe3+ > I2 |
| B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| C.上述实验中,共有两个氧化还原反应 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是
| A.Fe2+和S2O32—都是还原剂 |
| B.x=6 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.每生成1mol Fe3O4,反应转移的电子总数为3mol |
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br-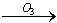 BrO-
BrO-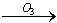 BrO2-
BrO2-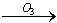 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |