题目内容
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
| A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性 |
| B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 |
| C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2 |
| D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72- |
D
解析试题分析:A、发生铬中毒时,解毒原理是将六价铬变为三价铬,需要加入还原剂才能实现,可服用具有还原性的维生素C缓解毒性,故A正确;B、K2Cr2O7可以氧化乙醇,产物呈紫色,该反应可用于检查酒后驾驶,故B正确;C、在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,根据电子守恒和原子守恒配平为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,氧化产物是碘单质,还原产物是三价铬离子,二者的物质的量之比为3:2,故C正确;D、氧气的氧化性弱于Cr2O72-,Cr3+在溶解的氧气的作用下不能被氧化为Cr2O72-,故D错误,答案选D。
考点:考查氧化还原反应的有关判断、计算和应用

已知 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 | B. 中硫元素被氧化 中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.1mol 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
已知:5PbO2+2 Mn2++4H+=5Pb2++2MnO4-+2H2O,下列说法正确的是( )
| A.PbO2为还原剂,具有还原性 |
| B.氧化产物与还原产物的物质的量之比为5:2 |
| C.生成1 mol的Pb2+,转移的电子数为 5 mol |
| D.酸性环境下PbO2 的氧化性强于的MnO4- |
下列应用涉及氧化还原反应的是
| A.粗盐提纯 | B.人工固氮 | C.工业制氧 | D.玻璃刻字 |
下列各组物质相互作用时,其中水既不作氧化剂,又不作还原剂,而反应仍属于氧化还原反应的是
| A.氟与水反应 | B.Na与水反应 | C.铝与强碱液作用 | D.过氧化钠与水反应 |
M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
反应:Cr2O72—+3SO32—+aH+=2Cr3++3Y+4H2O下列说法不正确的是
| A.Y是SO42— |
| B.a=8 |
| C.Cr2O72—被氧化成Cr3+ |
| D.生成1mol Cr3+时转移的电子数是3×6. 02×1023 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是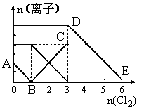
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6mol/L |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |