题目内容
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色(淀粉遇I2变蓝)。下列判断正确的是
| A.上述实验证明氧化性:MnO4->Cl2 > Fe3+ > I2 |
| B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| C.上述实验中,共有两个氧化还原反应 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
A
解析试题分析:A、根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的还原性,反应①氧化性MnO4->Cl2 ,反应②氧化性Cl2>Fe3+,反应③Fe3+>I2,正确;B、Cl2与KI反应生成I2,从而使淀粉变蓝,错误;C、题目所给3个反应都发生了化合价变化,都属于氧化还原反应,错误;D、实验②中Fe2+被氧化为Fe3+,只能证明Fe2+的还原性,错误。
考点:本题考查氧化还原反应的综合应用。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
反应:Cr2O72—+3SO32—+aH+=2Cr3++3Y+4H2O下列说法不正确的是
| A.Y是SO42— |
| B.a=8 |
| C.Cr2O72—被氧化成Cr3+ |
| D.生成1mol Cr3+时转移的电子数是3×6. 02×1023 |
下列类型的反应,一定不属于氧化还原反应的是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
在5NH4NO3 2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
| A.3∶5 | B.5∶3 | C.5∶2 | D.2∶1 |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.反应中硫酸作氧化剂 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是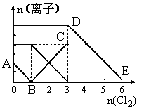
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6mol/L |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是 ( )
| A.上述反应属于氧化还原反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |