题目内容
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是
| A.Fe2+和S2O32—都是还原剂 |
| B.x=6 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.每生成1mol Fe3O4,反应转移的电子总数为3mol |
A
解析试题分析:A、根据方程式3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O可知,铁元素和硫元素的化合价升高,因此Fe2+和S2O32—都是还原剂,A正确;B、根据氢原子守恒可知,反应的离子方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,即x=4,故B错误;C、1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为 mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。
mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。
考点:考查氧化还原反应的有关判断和计算

已知:5PbO2+2 Mn2++4H+=5Pb2++2MnO4-+2H2O,下列说法正确的是( )
| A.PbO2为还原剂,具有还原性 |
| B.氧化产物与还原产物的物质的量之比为5:2 |
| C.生成1 mol的Pb2+,转移的电子数为 5 mol |
| D.酸性环境下PbO2 的氧化性强于的MnO4- |
反应:Cr2O72—+3SO32—+aH+=2Cr3++3Y+4H2O下列说法不正确的是
| A.Y是SO42— |
| B.a=8 |
| C.Cr2O72—被氧化成Cr3+ |
| D.生成1mol Cr3+时转移的电子数是3×6. 02×1023 |
在5NH4NO3 2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
| A.3∶5 | B.5∶3 | C.5∶2 | D.2∶1 |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.反应中硫酸作氧化剂 |
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH?外,还有Cl?、ClO?、ClO3?,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
| A.2:5 | B.3:1 | C.5:2 | D.1:1 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是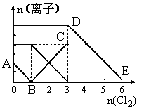
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6mol/L |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
下列说法正确的是
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是
| A.NaCl和O2 | B.NaClO3和NaClO | C.NaClO3和Cl2 | D.NaClO3和NaCl |