题目内容
8.下列反应中,氧化剂与还原剂物质的量的关系不是1:2的是( )| A. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | |
| B. | 3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O | |
| D. | O3+2KI+H2O=2KOH+I2+O2 |
分析 根据化合价降低作氧化剂,化合价升高作还原剂分析判断.
解答 解:A.3molC参加反应,2molC作还原剂,1molC作氧化剂,则氧化剂与还原剂物质的量之比为l:2,故A正确;
B.3molS参加反应,2molS化合价降低作氧化剂,1molS化合价升高作还原剂,则氧化剂与还原剂物质的量之比为2:1,故B错误;
C.在反应中1mol二氧化锰化合价降低作氧化剂,4molHCl参加反应,2molHCl化合价升高作还原剂,则氧化剂与还原剂物质的量之比为l:2,故C正确;
D.在反应中1mol臭氧参加反应,$\frac{1}{3}$mol臭氧化合价降低作氧化剂,2molKI化合价升高作还原剂,则氧化剂与还原剂物质的量之比为l:6,故D错误;
故选BD.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意只有化合价降低的才作氧化剂,化合价升高才作还原剂,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列物质的制备方法恰当的是( )
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
19.对于可逆反应,2SO2 (g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K,下列说法正确的是( )
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | K值越大SO2转化率越大 | D. | 升高温度K值增大 |
16.下列物质属于电解质的是( )
| A. | 氯化钠溶液 | B. | 酒精 | C. | 硫酸钠晶体 | D. | 二氧化碳 |
3.下列有关胶体的说法不正确的是( )
| A. | 电泳现象可证明胶体带有电荷 | |
| B. | 分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体 | |
| C. | 向Fe(OH)3胶体中滴入少量稀H2SO4,有红褐色沉淀产生 | |
| D. | 放电影时,放映室射到银幕上的光柱的形成属于丁达尔效应 |
17.有三种化合物:①NaHCO3、②Al(OH)3、③H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有② | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
14.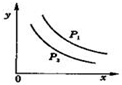 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )| A. | 上述正反应是放热反应 | B. | 上述正反应是吸热反应 | ||
| C. | 增大L的量,平衡正向移动 | D. | a<b |