题目内容
20.(1)在0.5L HCl和H2SO4的混合液中含有0.1molCl-,0.2molSO42-,溶液中c(H+)为1mol/L.(2)配制250mL 1.0mol/LH2SO4溶液,需要18mol/L H2SO4溶液的体积是多少?(写出计算过程)
分析 (1)根据电荷守恒:n(H+)=n(Cl-)+2n(SO42-),再根据c=$\frac{n}{V}$计算;
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算.
解答 解:(1)根据电荷守恒:n(H+)=n(Cl-)+2n(SO42-)=0.1mol+0.2mol×2=0.5mol,则溶液中c(H+)=$\frac{0.5mol}{0.5L}$=1mol/L,故答案为:1;
(2)根据稀释定律,稀释前后溶质的物质的量不变,则:
250mL×1.0mol/L=18mol/L×V(H2SO4)
解得V(H2SO4)=13.9mL
答:需要18mol/L H2SO4溶液的体积是13.9mL.
点评 本题考查物质的量难度有关计算,比较基础,注意对公式的理解与灵活应用,注意电解混合溶液中常利用电荷守恒进行计算.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为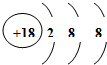 ;
;
(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式 ;
;
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑥ | ② | |||||
| 三 | ③ | ⑤ | ④ | ⑩ | ⑦ | ⑧ | ||
| 四 | ⑨ |
 ;
;(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式
 ;
;(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
11.下列说法正确的是( )
| A. | 卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘 | |
| D. | 处理废水时加入明矾作为净水剂可以除去水中悬浮的杂质 |
8.下列反应中,氧化剂与还原剂物质的量的关系不是1:2的是( )
| A. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | |
| B. | 3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O | |
| D. | O3+2KI+H2O=2KOH+I2+O2 |
15.下列说法正确的是( )
| A. | 需要0.2molNaOH固体,在托盘天平上称量时,砝码加上游码的质量等于0.8g | |
| B. | 配制一定物质的量浓度的NaCl溶液,定容时仰视凹液体,会导致溶液的浓度偏低 | |
| C. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| D. | AgCl难溶于水,在水中导电性较差,所以AgCl是非电解质 |
5.下列化学实验操作或事故处理方法中错误的是( )
| A. | 配制硫酸溶液时,可在量筒中加入一定体积的浓硫酸,再在搅拌条件下慢慢加入水 | |
| B. | 蒸馏时,冷凝管内的冷却水从下口进、上口出 | |
| C. | 不慎将酸溅到眼睛中,应立即用大量水冲洗,边洗边眨眼睛 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
12.下列说法错误的是( )
| A. | 阿司匹林属于解热镇痛药 | |
| B. | 青霉素有青霉素F、G、X、K、V | |
| C. | 胃舒平、苏打片均属于抗酸药 | |
| D. | 青霉素在体内水解可得到一类碱性物质 |
5.关于非金属元素N、O、Cl、S的叙述,正确的是( )
| A. | 在通常情况下其单质均为气体 | B. | 其单质均由双原子分子构成 | ||
| C. | 其单质都能跟某些金属单质反应 | D. | 每种元素仅生成一种氢化物 |
6.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. |  的消去产物有两种 的消去产物有两种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别乙醛、四氯化碳、苯和乙酸 |