题目内容
11.下列有关有机物的叙述正确的是( )| A. | 由乙烯与氧气在Ag作催化剂下反应制取环氧乙烷原子利用率可达100% | |
| B. | 高聚物的相对分子质量一定为单体相对分子质量的整数倍 | |
| C. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| D. |  分子中至少有14个原子共平面 分子中至少有14个原子共平面 |
分析 A.乙烯与氧气在银催化下加热制取环氧乙烷,产物只有一种;
B.缩聚反应产物的相对分子量不是单体相对分子质量的整数倍;
C. 为高聚物,含有酯基;
为高聚物,含有酯基;
D.根据苯环为平面结构及连接苯环的碳碳键可以旋转及苯的结构对称进行判断.
解答 解:A.乙烯与氧气在银催化下加热制取环氧乙烷,产物只有一种,故原子利用率为100%,故A正确;
B.高聚物分为加聚反应和缩聚反应产物,加聚反应产物的相对分子质量一定为单体相对分子质量的整数倍,而缩聚反应过程中脱去了1个小分子,所以高聚物的相对分子质量不一定为单体相对分子质量的整数倍,故B错误;
C. 为缩聚产物,含有羟基、羧基和酯基,故C错误;
为缩聚产物,含有羟基、羧基和酯基,故C错误;
D. 中理解苯环的碳碳键可以旋转,但苯为平面对称结构,无论怎样旋转,该有机物分子中共平面的原子至少为6+6+2+2=16个,故D错误.
中理解苯环的碳碳键可以旋转,但苯为平面对称结构,无论怎样旋转,该有机物分子中共平面的原子至少为6+6+2+2=16个,故D错误.
故选A.
点评 本题考查了有机物结构与性质、有机物官能团的判断,题目难度中等,注意掌握常见有机物结构与性质,明确常见官能团的类型,选项D为难点、易错点,注意把握有机物的空间结构.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
12.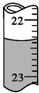 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )| A. | 22.30 mL | B. | 22.35 mL | C. | 23.65 mL | D. | 23.70 mL |
2.下列叙述正确的是( )
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减少 | |
| B. | 一定温度下,向一定量纯水中通入少量HCl气体后,水的电离平衡正向移动 | |
| C. | 中和等体积等物质的量浓度的氨水和NaOH溶液时,消耗等浓度的稀硫酸的体积氨水比NaOH溶液多 | |
| D. | 室温下,pH=5的硫酸铵和pH=9醋酸钠两溶液中,由水电离出的氢离子浓度相等 |
19.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
6.下列说法中正确的是( )
| A. | 蒸馏、分馏、干馏都属于物理变化 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 油脂水解可得到氨基酸和甘油 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
3.下列各组顺序的排列正确的是( )
| A. | 热稳定性:HCl>H2S>PH3 | B. | 原子半径:Na<Mg<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 碱性强弱:LiOH>NaOH>KOH |
20.能说明BF3分子的4个原子是同一平面的理由是( )
| A. | 两个键的之间夹角为120° | B. | B-F键的键能相同 | ||
| C. | 3个B-F键的键能相同 | D. | 3个B-F键的键长相等 |
1.对于下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 氯水可使石蕊试液先变红后褪色,说明氯水具有酸性、漂白性 |
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.