题目内容
18.下列有关说法中不正确的是( )| A. | 将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 | |
| B. | 高纯硅常用作光导纤维的原料 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
分析 A.盐酸的酸性强于亚硫酸,过量NH3与二氧化硫在水溶液中发生反应生成亚硫酸铵;
B.二氧化硅常用作光导纤维的原料;
C.氢氧化铝只能与强碱反应;
D.锌和铜在酸性条件下形成原电池反应,反应速率较大.
解答 解:A.盐酸的酸性强于亚硫酸,将SO2通入BaCl2溶液中至饱和,不发生反应,再通人过量NH3,过量NH3与二氧化硫在水溶液中发生反应生成亚硫酸铵,亚硫酸根离子与钡离子反应生成亚硫酸钡沉淀,故A正确;
B.二氧化硅常用作光导纤维的原料,故B错误;
C.因为氢氧化铝只能与强碱反应,又一水合氨为弱碱,与氯化铝反应生成氢氧化铝沉淀,所以用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好,故C正确;
D.加入少量CuSO4固体,置换出铜,锌和铜在酸性条件下形成原电池反应,反应速率较大,故D正确;
故选:B.
点评 本题考查元素化合物知识,熟悉氢氧化铝的性质等,熟悉原电池的应用是解题关键,题目难度不大.

练习册系列答案
相关题目
11.下列热化学方程式书写正确的是( )
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
9.下列有关物质结构的表述形式正确的是( )
| A. | 碳酸钠的化学式:NaCO3 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 硫原子的价电子排布式:3s23p4 | D. | 钠离子的结构示意图: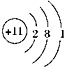 |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1 mol的-OH含有的电子数为NA | |
| B. | 9.2 g甲苯分子中处于同一平面的原子数最多为1.3NA | |
| C. | 标准状况下,2.8 g乙烯分子中含有的单键数为0.5NA | |
| D. | 标准状况下,2.24 L戊烷所含分子数为0.1NA |
13.下列各组化合物的水溶液中,碱的碱性减弱,酸的酸性增强的是( )
| A. | NaOH,LiOH,HNO3,H3PO4 | B. | Mg(OH)2,Al(OH)3,HBrO4,HClO4 | ||
| C. | Mg(OH)2,Ca(OH)2,H3PO4,H2SO4 | D. | NaOH,Mg(OH)2,H3PO4,HClO4 |
7. 用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )
用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )
 用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )
用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )| A. | 第1到第2分钟间混合物质质量减少最快 | |
| B. | EF段中,用盐酸表示该反应的平均速率为0.4mol•L-1•min-1 | |
| C. | OE、EF、FG三段中用CO2表示该反应的平均速率之比为2:4:1 | |
| D. | FG段溶液质量增加比EF段溶液质量增加快 |
 中相应官能团的名称及化学式
中相应官能团的名称及化学式 H、C、O、N、S、Cl是常见的几种非金属元素.
H、C、O、N、S、Cl是常见的几种非金属元素. .
.