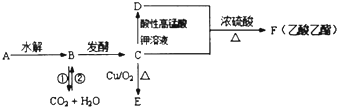
题目内容
6.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 0.1 mol的-OH含有的电子数为NA | |
| B. | 9.2 g甲苯分子中处于同一平面的原子数最多为1.3NA | |
| C. | 标准状况下,2.8 g乙烯分子中含有的单键数为0.5NA | |
| D. | 标准状况下,2.24 L戊烷所含分子数为0.1NA |
分析 A、1mol羟基含9mol电子;
B、求出甲苯的物质的量,然后根据1mol甲苯中最多有13个原子共平面来分析;
C、求出乙烯的物质的量,然后根据1mol乙烯中含4mol单键来分析;
D、标况下,戊烷为液态.
解答 解:A、1mol羟基含9mol电子,故0.1mol羟基含0.9mol电子即0.9NA个,故A错误;
B、9.2g甲苯的物质的量n=$\frac{9.2g}{92g/mol}$=0.1mol,而1mol甲苯中最多有13个原子共平面,故0.1mol甲苯中有1.3mol原子共平面,故B正确;
C、2.8g乙烯的物质的量为0.1mol,而1mol乙烯中含4mol单键,故0.1mol乙烯中含0.4NA条单键,故C错误;
D、标况下,戊烷为液态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | Na2O | B. | N2H4 | C. | Na2S2 | D. | NH4NO3 |
14.上海世博会开幕式于2010年4月30日顺利召开.世博会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图所示,下列关于该物质的说法正确的是( )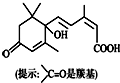

| A. | 其分子式为C15H22O4 | |
| B. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol NaOH | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
1.下列实验能获得成功的是( )
| A. | 苯和溴用铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硝酸酸化的AgNO3溶液检验Cl- | |
| D. | 向淀粉在酸性条件下水解的产物中加银氨溶液,水浴加热,检验葡萄糖的生成 |
11.下列电子式书写正确的是( )
| A. | 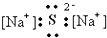 | B. |  | C. |  | D. |  |
18.下列有关说法中不正确的是( )
| A. | 将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 | |
| B. | 高纯硅常用作光导纤维的原料 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
15.实验室制取气体时,吸收尾气的方案,正确的是:( )
①向KMnO4晶体中加入浓盐酸,产生的气体进行漂白实验后的尾气用NaOH溶液吸收;
②向Na2SO3晶体中滴入浓H2SO4,尾气用氨水吸收;
③向FeS固体中滴入稀盐酸,最后的尾气用CuSO4溶液吸收;
④浓H2SO4与食盐晶体共热,将多余的气体用水吸收.
①向KMnO4晶体中加入浓盐酸,产生的气体进行漂白实验后的尾气用NaOH溶液吸收;
②向Na2SO3晶体中滴入浓H2SO4,尾气用氨水吸收;
③向FeS固体中滴入稀盐酸,最后的尾气用CuSO4溶液吸收;
④浓H2SO4与食盐晶体共热,将多余的气体用水吸收.
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
16.下列各组数据关系中,前者比后者的大是( )
| A. | 纯水100℃和25℃的pH值 | |
| B. | Na2CO3溶液中HCO3-和OH-数目 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 同温下pH=11的KOH与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |