题目内容
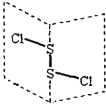
【题目】I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
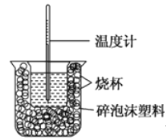
(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
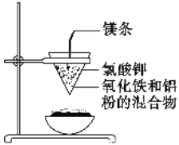
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。
【答案】I、(1)环形玻璃搅拌棒 (1分)双孔盖板(1分)(2)3(1分)
(3)①< (1分) ②NH3·H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少(1分)
③HCl(aq)+NH3H2O(aq)=NH4Cl(aq)+H2O(l) △H=-52.7kJ/mol (2分)
II、(1)2Al+Fe2O3![]() 2Fe+Al2O3 (2分) 铝热 (1分)
2Fe+Al2O3 (2分) 铝热 (1分)
(2)①②③④ (1分,漏选一个不得分)
(3)为防止溅落物炸裂蒸发皿 (1分)引燃剂 (1分)助燃剂 (1分)。
【解析】
试题分析:I、(1)根据中和热的测定装置及该图所示,图中有两处未画出,它们分别是)环形玻璃搅拌棒、双孔盖板;(2)做一次完整的中和热测定实验,温度计需测量反应前盐酸、氢氧化钠溶液的温度及二者混合反应后溶液的温度,故共需使用3次;(3)①反应热是酸、碱发生中和反应产生1mol水放出的热量。由于NH3H2O是弱碱,电离需要吸收热量,故反应产生1mol水放出的热量比强碱NaOH少,所以△H1<△H2;②两组实验结果差异的原因是NH3·H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少;③反应以不足量的HCl为标准计算,n(HCl)=n(H2O)= 1.0mol/L×0.05L=0.05mol,Q=cmt=4.184J/(g℃)×100g×(19.3-13) ℃=2635.92J,则△H=-2635.92J ÷0.05mol =-52718J/mol =-52.7kJ/mol,所以该反应的热化学方程式是HCl(aq)+NH3H2O(aq)=NH4Cl(aq)+H2O(l) △H=-52.7kJ/mol;II、(1)Al与Fe2O3在高温下发生反应产生氧化铝和铁,反应的化学方程式是2Al+Fe2O3![]() 2Fe+Al2O3;(2)①镁条在点燃时,剧烈燃烧,正确;②镁条燃烧反应是放热反应,反应放出大量的热,并发出耀眼的光芒,火星四射,正确;③反应放出的热量使纸漏斗的下部被烧穿,铁及氧化铝进入下面的容器中,正确;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体,正确。(3)在铝热反应中,不同的物质作用不相同,其中蒸发皿盛沙的作用是为防止溅落物炸裂蒸发皿;镁条的作用是引燃剂,为铝热反应的发生提供足量的能量;氯酸钾的作用是分解产生氧气,为镁条燃烧作助燃剂。
2Fe+Al2O3;(2)①镁条在点燃时,剧烈燃烧,正确;②镁条燃烧反应是放热反应,反应放出大量的热,并发出耀眼的光芒,火星四射,正确;③反应放出的热量使纸漏斗的下部被烧穿,铁及氧化铝进入下面的容器中,正确;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体,正确。(3)在铝热反应中,不同的物质作用不相同,其中蒸发皿盛沙的作用是为防止溅落物炸裂蒸发皿;镁条的作用是引燃剂,为铝热反应的发生提供足量的能量;氯酸钾的作用是分解产生氧气,为镁条燃烧作助燃剂。

【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
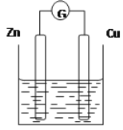
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。