题目内容
【题目】氮、磷、硫、氯、砷等是农药中的重要组成元素。请回答下列问题:
(1)基态砷的价电子排布式是___________________________;
(2)氨气比PH3沸点高的原因是______________________;
(3)下列有关氮、磷、硫、氯的说法正确的是__________;
a.第一电离能由小到大的顺序是S<P<Cl
b.PO43-、SO42-、ClO4-互为等电子体,它们的空间构型均为四面体
c.磷、硫、氯基态原子的未成对电子数依次增多
d.1mol(C2H5O)P=0分子中含有的δ键的数目为24×6.02×1023
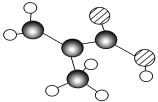
(4)氮化硼和磷化硼是受到高度关注的耐高温、耐磨涂料,两者结构相似。磷化硼晶胞结构如图所示,则磷化硼晶体中每个硼原子周围距离最近的磷原子数目为__________;晶体结构中存在的化学键有_______(填序号);

a.离子键b.共价键c.分子间作用力d.配位键
氮化硼晶体的熔点要比磷化硼晶体高,其原因______________________。
【答案】(1)4s24p3(2)氨气分子间存在氢键 (3) ac (4) 4 bd 磷化硼和氮化硼都属于原子晶体,而氮原子的半径比磷原子小,B-N共价键键长比B-P键短,键能大,所以氮化硼晶体的熔点要比磷化硼晶体的高
【解析】试题分析:(1)砷位于元素周期表的第四周期第VA族,外围电子排布为4s24p3;
(2)氨气分子间存在氢键,增大了熔沸点,则其沸点明显比PH3沸点高;
(3)a.根据元素周期律,S、P、Cl三种元素位于同一周期,但P最外层处于半充满状态,故按S、P、Cl的顺序第一电离能依次增大,故a正确;b.PO43-、SO42-、ClO4-原子数相同,电子总数也相同,互为等电子体,中心原子的价层电子对数都是4,都不含孤电子对数,空间构性都是四面体形,故b正确;c.磷基态原子的未成对电子数为3、硫基态原子的未成对电子数为2、氯基态原子的未成对电子数为1,则磷、硫、氯基态原子的未成对电子数依次减小,故c错误;d.每个(C2H5O)P=0分子中含有的δ键的数目为25,故d错误;答案为ac。
(4)由晶胞结构可知磷化硼晶体中每个硼原子周围距离最近的磷原子数目为4,BP晶体结构与单晶硅相似,BP属于原子晶体,每个B原子与4个P原子相连,与同一个B原子相连的P原子构成的空间构型为正四面体,原子晶体中原子间以共价键相结合,B与最近的四个P形成配位键,故答案为bd;原子晶体中,物质熔点与原子半径、键长成反比,磷原子的半径比氮原子大,N-B共价键键长比B-P小,键能大,所以氮化硼晶体的熔点要比磷化硼晶体高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族) ;
(2)8个元素的最高价氧化物的水化物中,酸性最强的是 (填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 ,稳定性最强的氢化物的结构式为 ;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式 ;
(5)用电子式表示元素①与⑥形成化合物的过程 。