题目内容
14.X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同.下列说法不正确的是( )| A. | 离子半径:X+>Y3+>Z2- | B. | 碱性:XOH>Y(OH)3 | ||
| C. | 单质的还原性:X>Y | D. | 原子序数:Y>X>Z |
分析 X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同,则离子具有2个电子层,故X为Na、Y为Al、Z为O,据此解答.
解答 解:X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同,则离子具有2个电子层,故X为Na、Y为Al、Z为O,
A.电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,故A错误;
B.金属性Na>Al,故碱性NaOH>Al(OH)3,故B正确;
C.金属性Na>Al,单质的还原性:Na>Al,故C正确;
D.X为Na、Y为Al、Z为O,原子序数:Al>Na>O,故D正确;
故选A.
点评 本题考查结构性质位置关系、元素周期律等,根据离子结构特点及处于短周期推断元素是关键.

练习册系列答案
相关题目
5.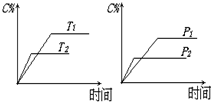 可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
 可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,增加A的量有利于平衡向右移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后升温,则平衡向左移动,且△H<0 |
2.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl,④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
9.已知H2(g)+Br2(l)═2HBr(g)△H=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,断裂1mol气态 H2、Br2、HBr分子内的化学键分别需要吸收的能量为436kJ、akJ、369kJ,则数据a为( )
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
19.0.25mol Ca(OH)2跟0.3mol H3PO4在一定条件下充分反应,得到CaHPO4和Ca(H2PO4)2,则这两种产物的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 4:1 |
6.下列使用漏斗的几个实验装置中,设计正确且能达到实验目的是( )


| A. | 用图甲所示装置制取并收集少量的N02气体(不考虑倒吸) | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图丁所示装置配制一定物质的量浓度的溶液 |

 .
.