题目内容
2.下列各离子浓度的大小比较,正确的是( )| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl,④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.铵根离子水解程度较小,则硫酸铵中铵根离子浓度最大;一水合氨的电离程度较小,则一水合氨中铵根离子浓度最小;碳酸氢根离子促进了铵根离子的水解,则碳酸氢铵溶液中的铵根离子浓度小于氯化铵;
B.溶液的pH=7,为中性,则c(H+)=c(OH-),根据电荷守恒进行判断;
C.根据碳酸钠溶液中的物料守恒进行判断;
D.酸性溶液中,c(H+)>c(OH-),根据电荷守恒可知c(Na+)<c(CH3COO-).
解答 解:A.同浓度下列溶液中,由于铵根离子水解程度较小,则①(NH4)2SO4铵根离子浓度最大;一水合氨的电离程度较小,则④NH3•H2O铵根离子浓度最小;碳酸氢根离子促进了铵根离子的水解,则②NH4HCO3 溶液中的铵根离子浓度小于③NH4Cl,所以c(NH4+)由大到小的顺序是:①>③>②>④,故A正确;
B.常温时,将等体积的盐酸和氨水混合后pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c (NH4+)=c (Cl-),故B错误;
C.0.2 mol•L-1Na2CO3溶液中,根据物料守恒可知:c(CO32-)+c(HCO3-)+c (H2CO3)=0.2 mol•L-1,故C正确;
D.醋酸钠溶液中加入适量醋酸,得到酸性溶液,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-),所以正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选AC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒等的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活运用基础知识的能力.

 天天练口算系列答案
天天练口算系列答案| A. | H2O | B. | Na2O | C. | MgCl2 | D. | KOH |
| A. | H2SO4 | B. | NH4Cl | C. | CH3COONa | D. | NaOH |
| A. | Al2(SO4)3 | B. | HCl | C. | Na2S | D. | NH3.H2O |
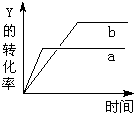 反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )| A. | 加入催化剂 | B. | 增大压强 | C. | 降低温度 | D. | 增大Y的浓度 |
| A. | 离子半径:X+>Y3+>Z2- | B. | 碱性:XOH>Y(OH)3 | ||
| C. | 单质的还原性:X>Y | D. | 原子序数:Y>X>Z |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L﹣1•mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
 ;
;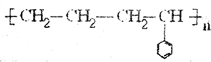 .
.