题目内容
20.x、y、z为三种元素的原子,已知x的阴离子与y、z的阳离子具有相同的电子层结构,且三种离子中z的阳离子半径最小,由此可知( )| A. | 原子半径:x>y>z | B. | 电负性:x>z>y | ||
| C. | 原子序数:y>z>x | D. | 第一电离能:z>y>x |
分析 x的阴离子与y、z的阳离子具有相同的电子层结构,离子核外电子数目相等,则y、z同周期且在x的小一周前,x为非金属元素,最外层电子数较多,y、z为金属元素,最外层电子数相对较少,三种离子中z的阳离子半径最小,则核电荷数z>y,结合元素周期律解答.
解答 解:x的阴离子与y、z的阳离子具有相同的电子层结构,离子核外电子数目相等,则y、z同周期且在x的小一周前,x为非金属元素,最外层电子数较多,y、z为金属元素,最外层电子数相对较少,三种离子中z的阳离子半径最小,则核电荷数z>y.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:y>z>x,故A错误;
B.同周期自左而右电负性增大、同主族自上而下电负性减小,故原子半径:x>z>y,故B正确;
C.由上述分析可知,原子序数:z>y>x,故C错误;
D.同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,但ⅡA元素第一电离能高于同周期相邻元素,与z的第一电离能可能大于y,也可能小于y,故D错误,
故选:B.
点评 本题考查结构性质位置的关系,关键根据离子具有相同的电子层结构推断元素的相对位置,注意对元素周期律的理解掌握,注意同周期第一电离能异常情况.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
10.稀释0.1mol/L的醋酸溶液,其中随水的增加而增大的有( )
(1)H+的物质的量 (2)c(H+) (3)c(OH-) (4)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ (5)$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$.
(1)H+的物质的量 (2)c(H+) (3)c(OH-) (4)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ (5)$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$.
| A. | (1)(3)(4) | B. | (1)(3)(5) | C. | (2)(4)(5) | D. | (1)(4)(5) |
11.某元素的一种放射性同位素质量数为131,中子数为78.下列叙述中正确的是( )
| A. | 其单质在常温下为白色固体 | |
| B. | 原子的最外电子层上有7个电子 | |
| C. | 其最高价氧化物对应水化物一定为强酸 | |
| D. | 其元素位于元素周期表中第五周期第 VII族 |
8.下列说法不正确的是( )
| A. | 对处于平衡状态的2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 | |
| B. | 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数减小 | |
| C. | 对于可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)达到平衡后,向反应体系中加入KCl固体,平衡向逆反应方向移动 | |
| D. | 合成氨时适当增大压强有利于提高氢气的转化率 |
15.下列实验操作或描述正确的是( )
| A. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 | |
| B. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 取用一小块钾后,剩余的钾可放回原试剂瓶里 | |
| D. | 将NaOH溶液滴加到AlCl3溶液中,振荡,制备Al(OH)3胶体 |
4.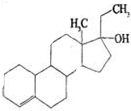 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A. | 该物质可以视为烃类 | B. | 该有机物的分子式为C20H32O | ||
| C. | 不能使溴的四氯化碳溶液褪色 | D. | 该物质分子中的所有碳原子均共面 |
1.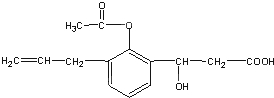 某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.
某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.
 某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.
某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
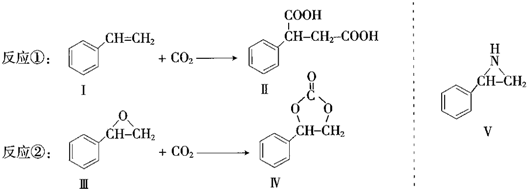
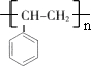 .
.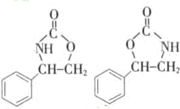 (任写一种).
(任写一种).