题目内容
6.任何一个化学反应中都会伴随能量变化和物质变化.(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示

生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 温度,物质的量,时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
分析 (1)由图1氢气和氧气生成1mol水蒸气断开旧化学键所吸收的总能量为436+249=685KJ,形成新化学键所释放的总能量为930KJ,据此分析;
(2)燃料电池燃料为负极,氧气为正极,工作时阴离子移向负极,电子由负极流向正极,据此分析;
(3)①根据使用了催化剂反应速率加快,达到平衡时间短判断;
②实验1中,根据V=$\frac{△c}{△t}$计算0〜l0min内生成HI的平均反应速率,再根据速率之比等于系数之比计算H2的平均反应速率;
根据平衡时I2(g)的体积分数=$\frac{n(I{\;}_{2})}{n(总)}$×100%计算;
③可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,据此分析解答.
解答 解:(1)由图1氢气和氧气生成1mol水蒸气断开旧化学键所吸收的总能量为436+249=685KJ,形成新化学键所释放的总能量为930KJ,所以断开旧化学键所吸收的总能量小于形成新化学键所释放的总能量,即氢气和氧气生成1mol水蒸气放热,因此水的分解反应为吸热反应,故答案为:小于;吸热;
(2)燃料电池燃料为负极,氧气为正极,所以a氢气为负极,b氧气为正极,
①所以电极b为该燃料电池的正极,故答案为:正;
②工作时阴离子移向负极,所以溶液中的OH-移向a极,故答案为:a;
③电子由负极a流向正极b,故答案为:a流向b;
(3)①根据实验1和实验2中数据,实验2达到平衡时间短,反应速率快,所以使用了催化剂,故答案为:2;
②实验1中,0〜l0min内HI的平均反应速率V=$\frac{△c}{△t}$=$\frac{\frac{1.0-0.8}{2}}{10}$=0.01mol/(L•min),又速率之比等于系数之比,则H2的平均反应速率=$\frac{1}{2}$×0.01mol/(L•min)=0.005mol/(L•min),实验3达平衡时HI剩余0.2mol,则分解了0.8mol,生成氢气和碘都是0.4mol,所以平衡时I2(g)的体积分数=$\frac{n(I{\;}_{2})}{n(总)}$×100%=$\frac{0.4}{1}$×100%=40%;故答案为:0.005;40%;
③A.因为化学反应前后系数相等,则压强一直不变,所以不能据此判断平衡状态,故A错误;
B.混合气体颜色色不再变化,则I2的浓度不再发生变化时,正逆反应速率相等,该反应达到平衡状态,故B正确;
C.因为反应前后总质量不变,又体积不变,所以密度一直不变,则不能据此判断平衡状态,故C错误;
故选:B.
点评 本题考查化学反应与能量、燃料电池以及化学平衡的计算与化学平衡状态的判断,题目难度不大,抓住基础是解题关键.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 新制氯气盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 固体碘常盛放在棕色细口瓶中 | |
| C. | 液溴易挥发,盛放在用水液封的棕色试剂瓶中 | |
| D. | 金属钠易被氧化,少量金属钠应储存在煤油中 |
| A. | v(B)=0.03mol•L-1•s-1 | B. | v(B)=0.045mol•L-1•s-1 | ||
| C. | v(C)=0.03mol•L-1•s-1 | D. | v(C)=0.06mol•L-1•s-1 |
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 制取乙酸乙酯时加入浓硫酸作催化剂可加快酯化反应的速率 | |
| D. | 实验室制取H2时,常用锌粒代替锌粉以降低反应的速率 |
| A. | 88 | B. | 102 | C. | 116 | D. | 196 |
| A. | 软脂酸和油酸互为同系物 | |
| B. | 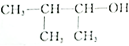 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| C. | 苯酚能与溴水反应,苯不能与溴水反应,说明羟基对苯环有影响 | |
| D. | 与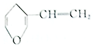 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 |
| A. | 硝酸 | B. | 盐酸 | C. | 石灰水 | D. | 乙醇 |
| A. | x:y等于等质量的甲和乙的分子个数之比 | |
| B. | x:y等于同温同压下甲和乙的密度之比 | |
| C. | x:y等于甲与乙的相对分子质量之比 | |
| D. | x:y等于同温同体积下等质量的甲和乙的压强之比 |
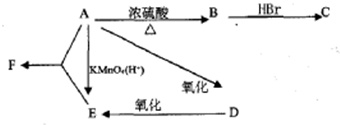 某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E.转变关系如图所示.已知B是石油化工发展水平的标志.
某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E.转变关系如图所示.已知B是石油化工发展水平的标志.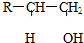 $→_{△}^{浓硫酸}$R-CH═CH2+H2O)
$→_{△}^{浓硫酸}$R-CH═CH2+H2O)