题目内容
11.某一元醇10g与乙酸反应生成乙酸乙酯11.17g,反应后又回收该醇1.8g,则醇的相对分子质量接近于( )| A. | 88 | B. | 102 | C. | 116 | D. | 196 |
分析 设一元醇为ROH,发生反应:CH3COOH+ROH→CH3COOR+H2O,参加反应的醇为10g-1.8g=8.2g,设醇的相对分子质量是M,则乙酸某酯的相对分子质量为(M+60-18),根据方程式中质量定比关系计算M.
解答 解:参加反应的醇为10g-1.8g=8.2g,
令一元醇为ROH,相对分子质量是M,则乙酸某酯的相对分子质量为(M+60-18)=M+42,则:
CH3COOH+ROH→CH3COOR+H2O
M (M+42)
8.2g 11.17g
所以M:(M+42)=8.2g:11.17g
解得M=116,
故选:C.
点评 本题考查化学方程式的有关计算,中等难度,试题注重对基础知识考查,侧重对学生能力的培养,关键在于根据质量守恒定律以及酯化反应的原理进行计算.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
2.下列物质的主要成分,不属于有机物的是( )
| A. | 光导纤维 | B. | 脱脂棉 | C. | 维生素 | D. | 液化石油气 |
19.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )


| A. | 氢氧化钾与硫酸的反应 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(0H)2•8H20晶体与NH4C1固体的反应 |
6.任何一个化学反应中都会伴随能量变化和物质变化.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示
生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
①实验1和实验2中使用了催化剂是实验2(填“1”或“2”)
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示

生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 温度,物质的量,时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
16.下列说法错误的是( )
| A. | 气体单质中一定存在σ键,可能存在π键 | |
| B. | 具有下列价电子排布式的基态原子中,①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | BF3、NCl3、H2O、XeF4、BeCl2分子中所有原子都满足最外层为8电子结构的是NCl3 |
3.用分液漏斗可以分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 硝基苯和水 | C. | 苯和溴苯 | D. | 汽油和乙醇 |
11.下列有关化学用语的表示正确的是( )
| A. | 过氧化氢的电子式为  | B. | 1,3-二甲基丁烷  | ||
| C. | Na+的结构示意图为 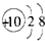 | D. | 乙烯的结构式为 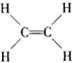 |
12.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 氯化铁溶液,溴水 | B. | 碳酸钠溶液,溴水 | ||
| C. | 高锰酸钾酸性溶液,溴水 | D. | 高锰酸钾酸性溶液,氯化铁溶液 |