题目内容
6.将等质量的四块铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻后铜片质量与加热前相同的是( )| A. | 硝酸 | B. | 盐酸 | C. | 石灰水 | D. | 乙醇 |
分析 铜丝灼烧变黑后,表面变为CuO,质量变大.
A、铜做乙醇催化氧化的催化剂,反应前后质量不变;
B、CuO是碱性氧化物,能和硫酸反应;
C、CuO是碱性氧化,能和硝酸反应,且铜本身也能和稀硝酸反应;
D、CuO是碱性氧化,和石灰水不反应.
解答 解:铜丝灼烧成黑色.是生成了CuO:2Cu+O2 $\frac{\underline{\;△\;}}{\;}$2CuO,灼烧后质量大于原来的质量.
A、铜丝灼烧成黑色,立即放入稀硝酸中,CuO、Cu与稀硝酸反应,生成铜盐,质量减少,故A错误;
B、铜丝灼烧成黑色,立即放入盐酸中,CuO与盐酸反应,生成铜盐,质量减少,故B错误;
C、铜丝灼烧成黑色,立即放入石灰水中,CuO与石灰水不反应,质量不变,仍比原来大,故C错误;
D、铜丝灼烧成黑色,立即放入乙醇中,CuO与乙醇反应:CuO+C2H5OH$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O,反应前后其质量不变,故D正确;
故选D.
点评 本题依托醇的催化氧化考查了铜及其化合物的性质,难度不大,要注重过程的分析.

练习册系列答案
相关题目
6.任何一个化学反应中都会伴随能量变化和物质变化.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示
生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
①实验1和实验2中使用了催化剂是实验2(填“1”或“2”)
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示

生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 温度,物质的量,时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
3.用分液漏斗可以分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 硝基苯和水 | C. | 苯和溴苯 | D. | 汽油和乙醇 |
1.在下列影响化学反应速率的因素中,一定能使化学反应速率加快的方法是( )
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
| A. | ①②③ | B. | ①④ | C. | ①③④ | D. | ①②③④ |
11.下列有关化学用语的表示正确的是( )
| A. | 过氧化氢的电子式为  | B. | 1,3-二甲基丁烷 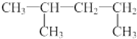 | ||
| C. | Na+的结构示意图为  | D. | 乙烯的结构式为  |
15.几种微粒具有相同的核电荷数,则可说明( )
| A. | 核外电子数一定相等 | B. | 一定是同一元素 | ||
| C. | 彼此之间一定是同位素 | D. | 可能是同一元素 |

 将一定量的铝镁合金投入到一定浓度的100mL盐酸中,合金全部溶解.向所得溶液中滴加5mol•L-1NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示.试计算:
将一定量的铝镁合金投入到一定浓度的100mL盐酸中,合金全部溶解.向所得溶液中滴加5mol•L-1NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示.试计算: