题目内容
18.下列说法正确的是( )| A. | 软脂酸和油酸互为同系物 | |
| B. |  的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| C. | 苯酚能与溴水反应,苯不能与溴水反应,说明羟基对苯环有影响 | |
| D. | 与 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 |
分析 A.软脂酸为饱和一元酸,油酸为不饱和一元酸;
B.含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
C.羟基的存在使得苯环上邻、对位氢原子变得活泼易发生取代;
D.同分异构体的芳香族化合物,说明是含有苯环结构的同分异构体,根据结构可知该有机物不饱和度为4,只含有1个苯环,苯环的不饱和度为4,所以侧链不存在不饱和键.
解答 解:A.软脂酸为饱和一元酸,油酸为不饱和一元酸,含有碳碳双键,故两者不是同系物,故A错误;
B.官能团的位次最小, 的名称为:3-甲基-2-丁醇,故B正确;
的名称为:3-甲基-2-丁醇,故B正确;
C.苯酚能与溴水反应,苯不能与溴水反应,说明羟基对苯环有影响,羟基的存在使得苯环上邻、对位氢原子变得活泼易发生取代反应,故C正确;
D.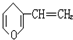 分子式为C7H8O.
分子式为C7H8O.
若只有1个侧链,含有苯环的同分异构体有 ,
,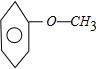 共2种.
共2种.
若有2个侧链,含有苯环同分异构体有 ,
,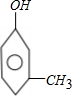 ,
,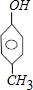 共3种.
共3种.
所以含有苯环同分异构体有5种,故D错误.
故选BC.
点评 本题考查了常见有机物的有机物的官能团和结构、高分子化合物的概念,难度中等,同分异构体主要有三种:碳链异构、官能团位置异构、官能团类别异构,答题时注意把握题给信息,为解答该题的关键.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
8.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 98g H2SO4和H3PO4中含有的氧原子数均为4NA | |
| B. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| C. | 33.6L NO2溶解于足量的水中得到硝酸溶液,溶液中NO3-数目为NA | |
| D. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
9.有Xn-、Yn+、Z三种粒子,其电子层结构相同.下列分析正确的是( )
| A. | 粒子半径大小的关系是Xn-<Yn+ | B. | Z一定是稀有气体元素 | ||
| C. | 原子序数关系是:Z>Y>X | D. | 原子半径关系是:X>Y |
6.任何一个化学反应中都会伴随能量变化和物质变化.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示
生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
①实验1和实验2中使用了催化剂是实验2(填“1”或“2”)
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示

生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 温度,物质的量,时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
13.已知在常温下,将NaOH溶液和一元酸HA溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
下列判断正确的是( )
| 实验编号 | c(NaOH)/mol•L-1 | c(HA)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | 0.4 | 0.4 | pH=9 |
| 丙 | 0.4 | c1 | pH=7 |
| 丁 | 0.2 | 0.4 | pH<7 |
| A. | 在乙组混合溶液中c(OH-)-c(HA)=10-9mol•L-1 | |
| B. | c1<0.4 | |
| C. | a>9 | |
| D. | 在丁组混合液中c(Na+)>c(A-)>c(H+)>c(OH-) |
3.用分液漏斗可以分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 硝基苯和水 | C. | 苯和溴苯 | D. | 汽油和乙醇 |
1.在下列影响化学反应速率的因素中,一定能使化学反应速率加快的方法是( )
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
| A. | ①②③ | B. | ①④ | C. | ①③④ | D. | ①②③④ |
19.下列反应属于取代反应的是( )
| A. | 甲烷燃烧 | B. | 乙烯与溴水反应 | ||
| C. | 甲烷与氯气在光照下反应 | D. | 乙烯通入酸性KMnO4溶液中 |