题目内容
1.下列关于化学反应速率的叙述不正确的是( )| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 制取乙酸乙酯时加入浓硫酸作催化剂可加快酯化反应的速率 | |
| D. | 实验室制取H2时,常用锌粒代替锌粉以降低反应的速率 |
分析 A、根据温度对化学反应速率的影响;
B、增加固体的量,反应速率不变;
C、根据催化剂可加快反应的速率判断;
D、根据固体接触面积小反应速率慢分析.
解答 解:A、温度降低,化学反应速率减慢,所以食物放在冰箱中会减慢食物变质的速率,故A正确;
B、因增加固体的量,反应速率不变,所以增加石灰石的用量不能来加快反应速率,故B错误;
C、因催化剂可加快反应的速率,所以制取乙酸乙酯时加入浓硫酸作催化剂可加快酯化反应的速率,故C正确;
D、因固体接触面积小反应速率慢,实验室制取H2时,为了减慢反应速率可以用锌粒代替锌粉,故D正确;
故选:B.
点评 本题主要考查了决定化学反应速率的因素和影响化学反应速率因素,难度不大.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1Mg(NO3)2溶液中含有0.2 NA个NO3- | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 3mol Cu和足量稀硝酸反应产生2 NA个NO分子 | |
| D. | 1 mol Cl2与足量NaOH溶液反应,转移电子数为NA |
9.有Xn-、Yn+、Z三种粒子,其电子层结构相同.下列分析正确的是( )
| A. | 粒子半径大小的关系是Xn-<Yn+ | B. | Z一定是稀有气体元素 | ||
| C. | 原子序数关系是:Z>Y>X | D. | 原子半径关系是:X>Y |
16.下列化学用语使用正确的是( )
| A. | F- 结构示意图: | |
| B. | 氯化钠的电子式: | |
| C. | 乙烯的结构简式:CH2=CH2 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe23++3SO42- |
6.任何一个化学反应中都会伴随能量变化和物质变化.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示
生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
①实验1和实验2中使用了催化剂是实验2(填“1”或“2”)
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
(1)氢气和氧气生成1mol水蒸气时的能量变化情况如图1所示

生成1mol水蒸气时,断开旧化学键所吸收的总能量小于(填“大于”、“小于”或“等于”)形成新化学键所释放的总能量,因此水的分解反应为吸热(填“吸热”或“放热”)反应.
(2)燃料电池是一种能量转换效率高、对环境友好的化学电源,图2为一种氢氧燃料电池的结构装置.①电极b为该燃料电池的正极(填“正”或“负”)
②电池工作时,溶液中的OH-移向a极(填“a”或“b”)
③电池工作时,电子会在外电路中定向移动.请在图2中标出电子的移动方向.a流向b
(3)在三个容积均为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 温度,物质的量,时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
②实验1中,0〜l0min内生成H2的平均反应速率为0.005 mol•L-1•min-1,
实验3的反应达到化学反应限度时,I2(g)的体积分数为40%.
③下列物质量不再变化时,能说明实給3中反应达到化学反应限度的是B
A.混合气体总压强 B.混合气体颜色色不再变化 C.混合气体密度.
13.已知在常温下,将NaOH溶液和一元酸HA溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
下列判断正确的是( )
| 实验编号 | c(NaOH)/mol•L-1 | c(HA)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | 0.4 | 0.4 | pH=9 |
| 丙 | 0.4 | c1 | pH=7 |
| 丁 | 0.2 | 0.4 | pH<7 |
| A. | 在乙组混合溶液中c(OH-)-c(HA)=10-9mol•L-1 | |
| B. | c1<0.4 | |
| C. | a>9 | |
| D. | 在丁组混合液中c(Na+)>c(A-)>c(H+)>c(OH-) |
1.在下列影响化学反应速率的因素中,一定能使化学反应速率加快的方法是( )
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
①升高温度
②增大压强
③增大反应物浓度
④将块状固体反应物磨成粉末.
| A. | ①②③ | B. | ①④ | C. | ①③④ | D. | ①②③④ |
 ;
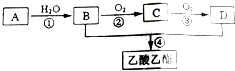
;
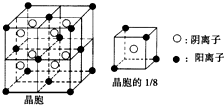 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示. .
.