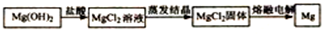题目内容
16.氮元素的单质和化合物在工、农业生产中用途广泛.而汽车尾气中含有NO等多种污染物.(1)常用作食品袋中填充气的是N2;(填化学式)常用作制冷剂的化合物是NH3,(填化学式)该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是NH3+HCl═NH4Cl.
(2)铵盐在农业上大多用作化肥.实验室可用固体铵盐NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示N2+O2 $\frac{\underline{\;高温\;}}{\;}$2NO.
(4)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是2NO+O2═2NO2、3NO2+H2O═2HNO3+NO.
分析 (1)氮气化学性质稳定,常用作食品袋中填充气,氨气易液化,属于碱性气体,易和氯化氢反应;
(2)铵盐可以和强碱反应生成氨气;
(3)空气中的氮气在放电或高温下反应生成NO;
(4)NO与空气的主要成份氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮.
解答 解:(1)N2化学性质稳定,常用作食品袋中填充气,NH3易液化,常作制冷剂,氨气属于碱性气体,易和氯化氢反应生成氯化铵,即NH3+HCl=NH4Cl,
故答案为:N2;NH3;NH3+HCl=NH4Cl;
(2)铵盐可以和强碱反应生成氨气,实验室用氯化铵和氢氧化钙反应来制取氨气,原理方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(3)空气中的氮气在放电或高温下反应生成NO,该反应为N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO;
(4)NO与空气的主要成份氧气反应生成二氧化氮,反应方程式为:2NO+O2═2NO2,二氧化氮与水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O═2HNO3+NO,所以NO对大气的影响之一是导致酸雨,
故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO.
点评 本题考查学生含氮元素物质的性质以及应用知识,注意知识的归纳和梳理是解题的关键,题目难度不大.

练习册系列答案
相关题目
6.某有机物溶解于NaOH溶液中(滴有酚酞试液的),开始溶液呈红色,煮沸几分钟后,溶液褪色,加入盐酸至酸性时,析出白色的晶体,该晶体溶于水,加入FeCl3溶液呈紫色,该有机物可能是( )
| A. | 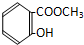 | B. | 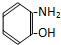 | C. | 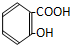 | D. | 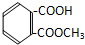 |
7.下列说法中,不正确的是( )
| A. | 向空气中大量排放SO2和NO2都能引起酸雨和光化学烟雾 | |
| B. | 不法分子制作假鸡蛋用的海藻酸钠、氯化钙以及碳酸钙都属于盐 | |
| C. | 明矾用于净水既与盐类的水解有关,又与胶体的性质有关 | |
| D. | FeS难溶于水(Ksp=6.3×10-18),但能除去水中的Cu2+(CuS的Ksp=1.3×10-36) |
11.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L甲苯中含有0.7NA个碳原子 | |
| B. | 7.8gNa2O2固体中含有的离子总数为0.4NA | |
| C. | 64g铜粉与足量的硫粉共热反应,转移的电子总数为2NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体中含有的原子总数为6NA |
8.下列能导电的物质是( )
| A. | 固态NaOH | B. | 酒精 | C. | 液态氯化氢 | D. | NaCl溶液 |
5.将Na、Mg、Al各0.3mol,分别放入100mL 2mol•L-1的盐酸中,同温同压下产生的气体的体积比是( )
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:2:2 | D. | 3:1:1 |