题目内容
11.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24L甲苯中含有0.7NA个碳原子 | |
| B. | 7.8gNa2O2固体中含有的离子总数为0.4NA | |
| C. | 64g铜粉与足量的硫粉共热反应,转移的电子总数为2NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体中含有的原子总数为6NA |
分析 A.气体摩尔体积只适用气体;
B.过氧化钠是由钠离子与过氧根离子构成;
C.铜与硫反应生成硫化亚铜;
D.NO2和N2O4的最简式相同,只需要计算92g NO2中原子数.
解答 解:A.标况下,甲苯为液体,不能使用气体摩尔体积,故A错误;
B.7.8gNa2O2固体的物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,含有0.2mol钠离子,0.1mol过氧根离子,共含有的离子总数为0.3NA,故B错误;
C.64g铜粉与足量的硫粉共热反应生成硫化亚铜,转移的电子总数为NA,故C错误;
D.NO2和N2O4的最简式相同,只需要计算92g NO2中原子数=$\frac{92g}{46g/mol}$×3×NA=6NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意铜与硫反应生成产物为硫化亚铜,注意过氧化钠中阴离子为过氧根离子,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列实验均发生了化学反应:①将铁钉放入CuSO4溶液中;②向FeSO4溶液中滴加稀硝酸;③将铜丝放入FeCl3溶液中.下列判断中,正确的是( )
| A. | 上述实验证明了氧化性:Fe3+>Fe2+>Cu2+ | |
| B. | 上述实验证明了Fe2+既有氧化性又有还原性 | |
| C. | 实验①中的化学反应是置换反应 | |
| D. | 向三个实验后的溶液中加入足量NaOH溶液振荡,最终都有Fe(OH)3生成 |
2.下列叙述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 原电池中电流由正极流向负极,阳离子向正极移动 | |
| D. | 用惰性电极电解AgNO3溶液一段时间后,加入一定质量Ag粉,溶液能恢复原状 |
19. 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )| A. | 最简单气态氢化物的稳定性③比⑦小 | |
| B. | ①与④能形成原子个数比为1:1的化合物 | |
| C. | ⑤和⑥的最高价氧化物对应的水化物可以反应 | |
| D. | 原子半径②>③>④ |
6.某同学做同族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助同学整理并完成实验报告:
(1)实验目的:探究同主族元素性质的相似性与递变性
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol/LNaBr溶液、0.1mol/LNaI溶液、CCl4等.
②仪器:胶头滴管、试管、烧杯、镊子、小刀、玻璃片等.
(3)实验内容(填写与实验方案对应的实验现象的标号及化学方程式和离子方程式)
(4)实验结论:同主族元素性质相似,自上而下元素金属性增强,非金属性减弱.
| 实验方案 | 实验现象 |
| ①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | C.浮在水面,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层橙红色 |
(1)实验目的:探究同主族元素性质的相似性与递变性
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol/LNaBr溶液、0.1mol/LNaI溶液、CCl4等.
②仪器:胶头滴管、试管、烧杯、镊子、小刀、玻璃片等.
(3)实验内容(填写与实验方案对应的实验现象的标号及化学方程式和离子方程式)
| 实验方案 | 实验现象 | 化学方程式 | 离子方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ |
3.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2.A、B、C、D四种元素在元素周期表中的相对位置如下表所示.
根据以上信息,下列叙述不正确的是( )
| … | A | ||||||
| B | C | D |
| A. | 元素C在元素周期表d区 | |
| B. | D的电子排布式为1s22s22p63s23p5 | |
| C. | A氢化物沸点高于D的氢化物沸点 | |
| D. | A和B的离子中,半径较小的是B的离子 |
20.对于mA(气)+nB(气)?pC(气)+qD(气)的平衡体系,当升高温度时,体系对氢气的相对密度从16.5变成16.9,则下列说法正确的是( )
| A. | m+n>p+q 正反应是放热反应 | B. | m+n>p+q 正反应是吸热反应 | ||
| C. | m+n<p+q 逆反应是放热反应 | D. | m+n=p+q 逆反应是吸热反应 |
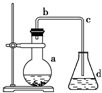 中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.
中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.