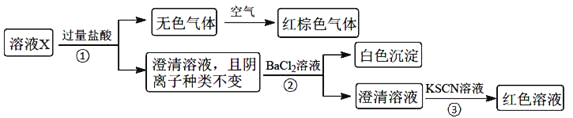
题目内容
【题目】下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
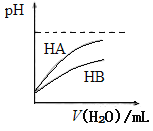
B.如上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应
【答案】B
【解析】
A、将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,恰好完全反应,得到醋酸钠溶液,醋酸根离子水解,使溶液显碱性,A正确;
B、pH相同的HA与HB两种酸稀释相同的倍数时,HA的pH增大的多,说明HA的酸性比HB的酸性强,根据盐水解的越弱越水解规律,则同浓度的NaA溶液与NaB溶液相比,后者溶液的碱性强,pH较大,B错误;
C、25℃时,pH=2的1.0L醋酸溶液中氢离子的浓度是10-2mol/L,则溶液中氢氧根离子的浓度是10-12mol/L,氢氧根离子来自水的电离,水电离产生的氢离子与氢氧根离子相等,所以水电离产生的氢离子浓度是数目为10-12mol/L,溶液体积为1.0L时,数目是10-12NA,C正确;
D、根据反应自发进行的条件,焓减熵增时一定自发,吸热反应为焓增的反应,若自发进行,则一定是熵增的反应,D正确;
答案选B。

练习册系列答案
相关题目