题目内容
7.氨是生产氮肥、尿素等物质的重要原料.(1)合成氨反应N2(g)+3H2(g)═2NH3(g)在一定条件下能自发进行的原因是△H<0.电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是N2+6H++6e-=2NH3.
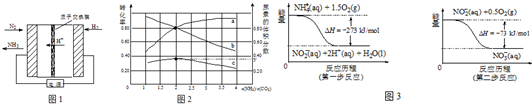
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)═CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示.a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化.[n(NH3)/n(CO2)]=2时,尿素产量最大;经计算,图中y=0.36(精确到0.01).
(3)废水中含氮化合物的处理方法有多种.
①NaClO溶液可将废水中的NH${\;}_{4}^{+}$转化为N2.若处理过程中产生N2 0.672L(标准状况),则需要消耗0.3mol•L-1的NaClO溶液0.3L.
②在微生物的作用下,NH${\;}_{4}^{+}$经过两步反应会转化为NO${\;}_{3}^{-}$,两步反应的能量变化如图3所示.则1mol NH${\;}_{4}^{+}$(aq)全部被氧化成NO${\;}_{3}^{-}$(aq)时放出的热量是346kJ.
③用H2催化还原法可降低水中NO${\;}_{3}^{-}$的浓度,得到的产物能参与大气循环,则反应后溶液的pH升高(填“升高”、“降低”或“不变”).
分析 (1)N2(g)+3H2(g)═2NH3(g)的△S<0,自发进行可知△H-T△S<0;合成氨的阴极上氮气得到电子生成氨气;
(2)由图可知,横坐标为n(NH3)/n(CO2)=2时,尿素的体积分数最大,且y点氨气的转化率为80%,以此计算氨气的体积分数;
(3)①N失去电子,Cl得到电子,遵循电子守恒;
②由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式;
③H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
解答 解:(1)N2(g)+3H2(g)═2NH3(g)的△S<0,自发进行可知△H-T△S<0,则△H<0,合成氨的阴极反应为N2+6H++6e-=2NH3,
故答案为:△H<0;N2+6H++6e-=2NH3;
(2)由图可知,横坐标为n(NH3)/n(CO2)=2时,尿素的体积分数最大,且y点氨气的转化率为80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始浓度(mol.L-1 ) 2 1 0 0
变化浓度(ol.L-1 ) 1.6 0.8 0.8 0.8
平衡浓度(mol.L-1 ) 0.4 0.2 0.8 0.8
平衡CO(NH2)2的体积分数y=$\frac{0.8}{0.4+0.2+0.8+0.8}$=0.36,
故答案为:2;0.36;
(3)①N失去电子,Cl得到电子,设消耗0.3mol•L-1的NaClO溶液为xL,由电子守恒可知,0.3mol×xL×2=$\frac{0.672L}{22.4L/mol}$×2×3,解得x=0.3,
故答案为:0.3;
②由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,即放出346kJ的热量,
故答案为:346;
③H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高,故答案为:升高.
点评 本题以信息的形式考查氧化还原反应、离子反应及热化学反应、化学平衡计算,注重对化学用语的考查,注意知识与题目信息的结合来解答,对学生能力要求较高,题目难度中等.

| A. | 将水加热,平衡向正向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,水电离的c(OH-)增大 | |
| C. | 向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 | |
| D. | 向水中加入少量NaHSO4固体,水的电离平衡向逆向移动,c(H+)增大 |
| A. | 1molCl2与足量的铁反应转移的电子数是2NA | |
| B. | 常温常压下22.4L HCl气体含有的分子数是NA | |
| C. | 0.1mol/L CuCl2溶液中Cl-数目是0.2NA | |
| D. | 32gO2中含有的原子数是NA |
| A. | pH=1的溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | c (Fe3+)=0.1 mol•L-1 的溶液中:Na+、NO${\;}_{3}^{-}$、SCN-、SO${\;}_{4}^{2-}$ | |
| C. | 使酚酞试液变红色的溶液中:Na+、Ba2+、I-、Cl- | |
| D. | 水电离的c (H+)=1×10-13mol•L-1的溶液中:K+、Na+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
| A. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1CH3COONa溶液与0.1 mol•L-1CH3COOH溶液等体积混合(pH=4.75):c (CH3COO-)+c (CH3COOH)=2 c(Na+) | |
| C. | 0.1mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.1mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:c (HCO${\;}_{3}^{-}$)+2c (H+)+3c (H2CO3)=c(CO${\;}_{3}^{2-}$)+2c(OH-) |
| A. | 用铁矿石冶炼铁 | B. | 用食醋清除暖水瓶中的水垢 | ||
| C. | 用煤生产水煤气 | D. | 干冰放在通风处自然升华 |
| A. | Na2O用作呼吸面具的供氧剂 | |
| B. | 氧化铝常用于制造耐火材料 | |
| C. | 米汤可检验碘盐中的碘酸钾 | |
| D. | 食品包装袋内放入生石灰可以防止食品因氧化而变质 |
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 氨基钠和氢化钠的晶体中都只含离子键 | |
| D. | 方程式①中,氨基钠是还原剂 |
| A. | 第2周期ⅢA族 | B. | 第2周期ⅥA族 | C. | 第3周期ⅤA族 | D. | 第3周期ⅢA族 |