题目内容
17.某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1.该元素在周期表中的位置( )| A. | 第2周期ⅢA族 | B. | 第2周期ⅥA族 | C. | 第3周期ⅤA族 | D. | 第3周期ⅢA族 |
分析 根据化学方程式4M+3O2$\frac{\underline{\;点燃\;}}{\;}$2M2O3计算M的相对原子质量,确定元素种类,进而得到其在周期表中的位置.
解答 解:设金属M的相对原子质量是x,
根据化学方程式:4M+3O2$\frac{\underline{\;点燃\;}}{\;}$2M2O3
4x 2(2x+48)
1.8g 3.4g
$\frac{4x}{1.8g}$=$\frac{2(2x+48)}{3.4g}$,解得x=27,所以M是金属Al,在周期表中的位置是第三周期ⅢA族,
故选D.
点评 本题考查学生化学方程式的计算知识,知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.三个相同的恒温恒容密闭容器中分别盛有等质量的H2、CH4、O2,下列说法正确的是( )
| A. | 三种气体的分子数目一定相等 | B. | 三种气体物质的量之比为16:2:1 | ||
| C. | 三种气体的密度之比为1:2:16 | D. | 三种气体的压强一定相等 |
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,将足量金属镁在2.24LO2中完全燃烧,转移的电子总数为0.2NA | |
| B. | 1L0.1mol.L-1CH3COOH溶液中所含溶质的分子总数小于0.1NA | |
| C. | 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA | |
| D. | 标准状况下,22.4 L水中含有的氧原子数为1.0NA |
7.“白色污染”的主要危害是( )
①破坏土壤结构 ②降低土壤肥效 ③污染地下水④危及海洋生物的生存.
①破坏土壤结构 ②降低土壤肥效 ③污染地下水④危及海洋生物的生存.
| A. | ①② | B. | ②③ | C. | ①②③④ | D. | ②④ |
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.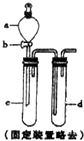 某兴趣小组采用如图装置制取并探究SO2气体的性质.
某兴趣小组采用如图装置制取并探究SO2气体的性质.