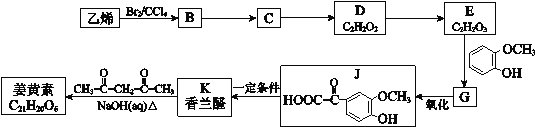
��Ŀ����
����Ŀ��[��ѧ�D�Dѡ��2����ѧ�뼼��]�������Ҷ�����������ԭ���ͳ����������ڽ������⡢֯��Ư��ϡ��������һ���Ʊ��������������ᾧˮ���Ĺ����������£�

�ش��������⣺
��1��CO��NaOH��һ�������ºϳɼ����ơ������Ƽ�������Ļ�ѧ��Ӧ����ʽ�ֱ�Ϊ �� ��
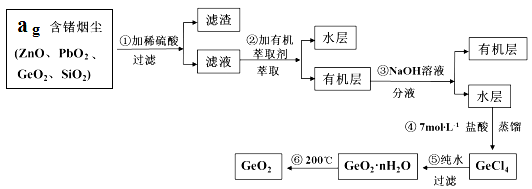
��2�����Ʊ������������ι��˲���,���˲����ٵ���Һ�� �������� _____�����˲����ڵ���Һ�� __�� ��������________ ��
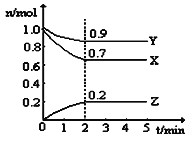
��3�����չ����Тۺܵ͢�Ŀ���� ��
��4�����˽�������������ֱ���������ữ�Ʊ����ᡣ�÷�����ȱ���Dz�Ʒ���������к��е�������Ҫ�� ��
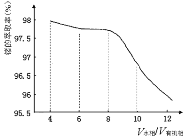
��5���ᾧˮ�ϲ����Ʒ�Ĵ����ø�����ط��ⶨ�����������Ʒ0.250g����ˮ����0.0500mol/L������KMnO4��Һ�ζ�����dz�ۺ�ɫ�����ʣ�����KMnO4��Һ15.00mL����Ӧ�����ӷ���ʽΪ ����ʽ����ó�Ʒ�Ĵ��� ��
���𰸡���1��CO��NaOH![]() HCOONa��2HCOONa
HCOONa��2HCOONa![]() Na2C2O4 + H2��
Na2C2O4 + H2��
��2��NaOH��Һ��CaC2O4��H2C2O4��Һ��H2SO4��Һ��CaSO4 ��5����
��3���ֱ�ѭ����������������Һ�����������ͳɱ�������С��Ⱦ����1���� ��4��Na2SO4 ��1����
��5��5C2O42��+2MnO4��+16H+��2Mn2++8H2O+10CO2����2���� 94.5% ��2����
��������
�����������1��������������ͼ��֪��CO��NaOH��һ�������ºϳɼ����Ʒ���ʽΪCO��NaOH![]() HCOONa�������Ƽ���������ͬʱ���в��������ɣ���˷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ2HCOONa
HCOONa�������Ƽ���������ͬʱ���в��������ɣ���˷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ2HCOONa![]() Na2C2O4 + H2����
Na2C2O4 + H2����
��2�����ݷ�Ӧԭ�����ܽ����Լ�ʾ��ͼ��֪�����˲���������Һ��NaOH��Һ��������CaC2O4�����˲���������Һ��H2C2O4��Һ��H2SO4��Һ��������CaSO4��
��3�����ݹ��չ��̿�֪�����բۿ���ѭ�������������ƣ����բܿ���ѭ���������ᣬ�������ԭ�ϵ������ʣ��ֽ����˳ɱ�����С��Ⱦ��
��4�������������IJ���Ϊ�����ƣ�ֱ���������ữ�����ɲ���������ƣ����к��е�������Ҫ��Na2SO4��
��5���ڲⶨ�����У��������Ϊ������������Ϊ��ԭ������Ӧ�����ӷ���ʽ5C2O2- 4 + 2MnO- 4 + 16H+ = 2Mn2+ + 8H2O + 10CO2�������ݷ���ʽ�ɵù�ϵʽ��
5H2C2O4��2H2O ~ 2KMnO4
5 2
n 0.05mol/L��15.0��10-3L
���n��H2C2O4��2H2O��=1.875��10-3mol
��m��H2C2O4��2H2O��=1.875��10-3mol��126g/mol=0.236g
���Գ�Ʒ�Ĵ��Ȧ�=![]() ��100%=94.5%��
��100%=94.5%��

����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�2NO + 2CO![]() 2CO2 + N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2 + N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
c(CO)/mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��ش���������(���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ��):
��1�� ǰ3s��ƽ����Ӧ����v(N2)��_____________��(�𰸱���2λС��)
��2�� ����4sʱCO��ת���ʦ� �� ��
��3�� ���д�ʩ�����NO��COת���CO2��N2�ķ�Ӧ���ʵ���( )
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D.��С���������
��4�� �о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ���� | T/�� | NO��ʼŨ��/mol��L-1 | CO��ʼŨ��/ mol��L-1 | �����ıȱ����/m2��g-1 |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
�� | 124 | |||
�� | 350 | 124 |
�������ϱ���������ʣ���ʵ���������ݡ�
�����ڸ���������ͼ�У������ϱ��еĢ�����ʵ�������»��������NOŨ����ʱ��仯����������ͼ������������������ʵ���š�