题目内容
【题目】离子液体是在室温和室温附近温度下呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
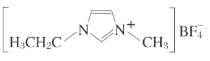
(1)B原子核外有___种运动状态不同的电子。BF4-中,B原子价层电子对数为___,与BF4-互为等电子体的分子为___(填分子式,写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是___,它们性质相似的原因是___。
(2)NH3极易溶于水的原因与氢键有关,结合NH3·H2O的电离推测NH3·H2O的合理结构式为___(填字母)。
A.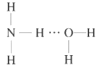 B.
B.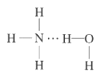 C.
C.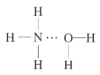 D.
D.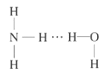
(3)该离子液体常温下为液体,而NaBF4常温下为固体,原因是___。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则该离子液体的阳离子中存在一个大π键,可表示为___。
),则该离子液体的阳离子中存在一个大π键,可表示为___。
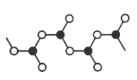
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图所示,其离子的化学式可用通式表示为___(用n代表B原子数)。
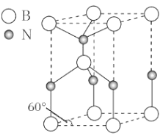
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图所示。已知该晶胞底面为菱形,其边长为acm,高为bcm,晶体密度为ρg/cm3,则阿伏加德罗常数NA为___mol-1(列出计算式)。
【答案】5 4 CCl4或SiF4 Si 电负性相近 B 均为离子晶体,NaBF4的晶格能大,所以熔点高 ![]() (BO2)nn-或(BnO2n)n-
(BO2)nn-或(BnO2n)n- ![]() 或
或![]()
【解析】
(1)B为5号元素;根据价层电子对个数=σ键个数+孤电子对个数计算BF4-中B原子价层电子对数;结合等电子体的概念分析解答;根据对角线规则分析解答;
(2)根据NH3·H2O![]() NH4++OH-推测NH3·H2O的合理结构;
NH4++OH-推测NH3·H2O的合理结构;
(3)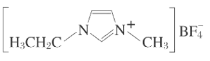 和NaBF4均为离子晶体,结合晶格能的大小与熔沸点的关系分析解答;
和NaBF4均为离子晶体,结合晶格能的大小与熔沸点的关系分析解答;
(4) 的环中的大π键由3个碳原子和2个N原子,每个C有1个电子参与形成大π键,每个N有2个电子参与形成大π键,环带有一个单位正电荷,据此分析判断;
的环中的大π键由3个碳原子和2个N原子,每个C有1个电子参与形成大π键,每个N有2个电子参与形成大π键,环带有一个单位正电荷,据此分析判断;
(5)根据图示,黑球表示B原子,白球表示O原子,根据均摊法计算判断结构中B原子和O原子的数目比,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,据此书写该离子的化学式的通式;
(6)根据均摊法计算晶胞中含有B和N原子数,再计算晶胞的质量和晶胞的体积,结合晶体密度的计算方法列式计算。
(1)B为5号元素,原子核外有5种运动状态不同的电子;BF4-中,B原子价层电子对数为4+![]() =4,与BF4-互为等电子体的分子为CCl4或SiF4或CF4或SiCl4;根据对角线规则,在周期表中,与B的化学性质最相似的邻族元素是Si,它们性质相似,是因为电负性相近,故答案为:5;4;CCl4或SiF4或CF4或SiCl4;Si;电负性相近;
=4,与BF4-互为等电子体的分子为CCl4或SiF4或CF4或SiCl4;根据对角线规则,在周期表中,与B的化学性质最相似的邻族元素是Si,它们性质相似,是因为电负性相近,故答案为:5;4;CCl4或SiF4或CF4或SiCl4;Si;电负性相近;
(2)NH3极易溶于水的原因与氢键有关,根据NH3·H2O![]() NH4++OH-,可以推测NH3·H2O的合理结构式为
NH4++OH-,可以推测NH3·H2O的合理结构式为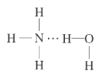 ,故答案为:B;
,故答案为:B;
(3) 和NaBF4均为离子晶体,
和NaBF4均为离子晶体, 常温下为液体,而NaBF4常温下为固体,是因为NaBF4的晶格能大,使得熔点NaBF4比
常温下为液体,而NaBF4常温下为固体,是因为NaBF4的晶格能大,使得熔点NaBF4比 高,故答案为:均为离子晶体,NaBF4的晶格能大,所以熔点高;
高,故答案为:均为离子晶体,NaBF4的晶格能大,所以熔点高;
(4) 的环中的大π键由3个碳原子和2个N原子、每个C形成3个σ键,有1个电子参与形成大π键,每个N形成3个σ键,有2个电子参与形成大π键,环带有一个单位正电荷,共6个电子参与形成大π键,该大π键可表示为
的环中的大π键由3个碳原子和2个N原子、每个C形成3个σ键,有1个电子参与形成大π键,每个N形成3个σ键,有2个电子参与形成大π键,环带有一个单位正电荷,共6个电子参与形成大π键,该大π键可表示为![]() ,故答案为:
,故答案为:![]() ;
;
(5)某硼的含氧酸根离子为无限链状结构,根据图示,黑球表示B原子,白球表示O原子,结构中BO3结构单元通过氧原子连接形成链状结构,则B原子和O原子的数目比=1∶(2×![]() +1)=1∶2,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,因此该离子的化学式可用通式(BO2)nn-或(BnO2n)n-表示,故答案为:(BO2)nn-或(BnO2n)n-;
+1)=1∶2,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,因此该离子的化学式可用通式(BO2)nn-或(BnO2n)n-表示,故答案为:(BO2)nn-或(BnO2n)n-;
(6)根据图示,晶胞中含有B原子数为4×![]() +4×
+4×![]() +1=2,N原子数为2×
+1=2,N原子数为2×![]() +2×
+2×![]() +1=2,因此晶胞的质量为
+1=2,因此晶胞的质量为![]() g,晶胞的体积为
g,晶胞的体积为![]() =
=![]() cm3,则晶体密度ρg/cm3=
cm3,则晶体密度ρg/cm3=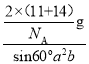 =
=![]() g/cm3,则NA=
g/cm3,则NA=![]() =
=![]() ,故答案为:
,故答案为:![]() 或
或![]() 。
。